Vor gut 120 Jahren, im Jahr 1902, veröffentlichte der britische Autor Rudyard Kipling eine Geschichtensammlung mit dem Titel „Just So Stories for Little Children“: logisch klingende, aber frei erfundene Erklärungen dafür, wie Tiere zu ihren auffälligsten Merkmalen gekommen sind, etwa das Kamel zu seinem Höcker oder der Elefant zu seinem Rüssel. Ihren Titel verdankt die Sammlung der Forderung seiner jungen Tochter, dass er die Geschichten „genau so“ erzählen oder vorlesen müsse, jeden Abend exakt gleich. In Anlehnung an Kipling bezeichnen Evolutionsbiologen schwer überprüfbare (oder zumindest noch nicht überprüfte), aber verführerisch einleuchtend klingende Erklärungen für die evolutionäre Herausbildung von tierischen Merkmalen oder menschlichen Eigenschaften als Just-so-Stories.
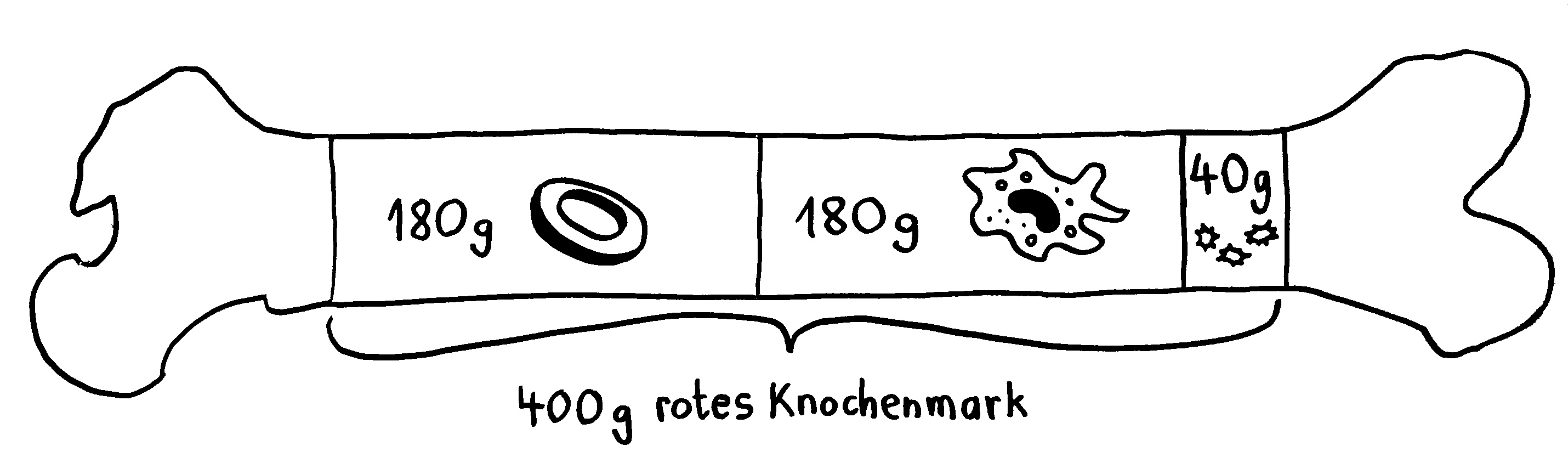
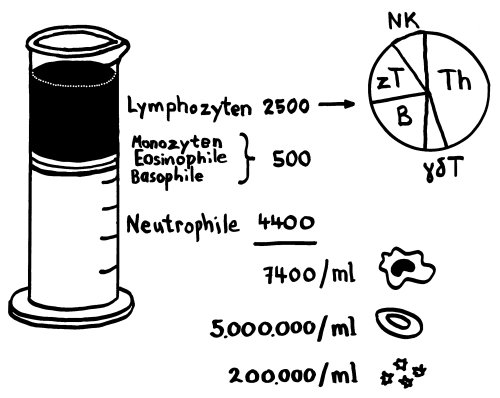
Die roten Blutkörperchen oder Erythrozyten der Säugetiere sind scheibenförmig und in der Mitte dünner als am Rand, denn sie enthalten keinen Zellkern und keine Organellen, dafür aber viel Hämoglobin, um Sauerstoff aus den Lungen über die Blutbahn in die Organe zu transportieren:
 In Fischen, Amphibien und Reptilien haben die Erythrozyten dagegen einen Kern, und sie übernehmen wichtige Aufgaben im Immunsystem. So helfen sie bei der Bekämpfung von Viren-, Bakterien- und Pilz-Infektionen, etwa durch die Ausschüttung von Botenstoffen und reaktiven Sauerstoffspezies oder durch die Bindung, Aufnahme, Verarbeitung und Präsentation von Antigenen. Zwar enthalten sie auch Hämoglobin und dienen dem Sauerstofftransport, aber daneben sind sie vollwertige, wehrhafte Immunzellen:
In Fischen, Amphibien und Reptilien haben die Erythrozyten dagegen einen Kern, und sie übernehmen wichtige Aufgaben im Immunsystem. So helfen sie bei der Bekämpfung von Viren-, Bakterien- und Pilz-Infektionen, etwa durch die Ausschüttung von Botenstoffen und reaktiven Sauerstoffspezies oder durch die Bindung, Aufnahme, Verarbeitung und Präsentation von Antigenen. Zwar enthalten sie auch Hämoglobin und dienen dem Sauerstofftransport, aber daneben sind sie vollwertige, wehrhafte Immunzellen:
 Dass die roten Blutkörperchen der Säugetiere ihre Kerne kurz nach der Entstehung im Knochenmark abstoßen, klingt zunächst nach einem Rückschritt. Denn da sie ohne Kerne und Organelle keine Proteine mehr produzieren können, spielen sie im Immunsystem der Säuger eine so untergeordnete Rolle, dass sie in Listen der Zelltypen des Immunsystems meist gar nicht aufgeführt werden. Stattdessen konzentrieren sich die abgeflachten Zellen ganz auf den Sauerstofftransport; das Hämoglobin macht 90 Prozent ihres Trockengewichts aus.
Dass die roten Blutkörperchen der Säugetiere ihre Kerne kurz nach der Entstehung im Knochenmark abstoßen, klingt zunächst nach einem Rückschritt. Denn da sie ohne Kerne und Organelle keine Proteine mehr produzieren können, spielen sie im Immunsystem der Säuger eine so untergeordnete Rolle, dass sie in Listen der Zelltypen des Immunsystems meist gar nicht aufgeführt werden. Stattdessen konzentrieren sich die abgeflachten Zellen ganz auf den Sauerstofftransport; das Hämoglobin macht 90 Prozent ihres Trockengewichts aus.
Über den Grund für den Verlust des Zellkerns der Säugetier-Erythrozyten kursiert eine Just-so-Story: Fische, Amphibien und Reptilien sind wechselwarme (poikilotherme oder ektotherme) Tiere, deren Körpertemperatur von der Umgebungstemperatur abhängt. Säugetiere sind dagegen gleichwarme (homoiotherme oder endotherme) Tiere, umgangssprachlich auch Warmblüter genannt. In dem meisten Lebenslagen müssen sie viel Energie aufwenden, um ihren Körper aufzuheizen. Dadurch sind sie weniger abhängig vom Wetter, können beispielsweise ihre Jungen im Leib austragen und vielfach auch im Winter aktiv bleiben. Um die Wärme zu generieren, braucht ihr Gewebe viel Energie, und um Energieträgermoleküle wie ATP aufzubauen, braucht es sehr viel Sauerstoff. Den schaffen die roten Blutkörperchen herbei. Also weg mit deren Zellkernen, her mit Unmengen an Hämoglobin, um den Körper mit Sauerstoff zu versorgen!
 Klingt logisch – zumal Säugetiere ja zumeist an Land leben und nicht ständig in einer Bakterien- und Virensuppe herumschwimmen, während Fische und auch Amphibienlarven das Wasser sogar durch ihre Kiemen filtern, also ständig sehr eng mit vielen Krankheitserregern in Berührung kommen.
Klingt logisch – zumal Säugetiere ja zumeist an Land leben und nicht ständig in einer Bakterien- und Virensuppe herumschwimmen, während Fische und auch Amphibienlarven das Wasser sogar durch ihre Kiemen filtern, also ständig sehr eng mit vielen Krankheitserregern in Berührung kommen.
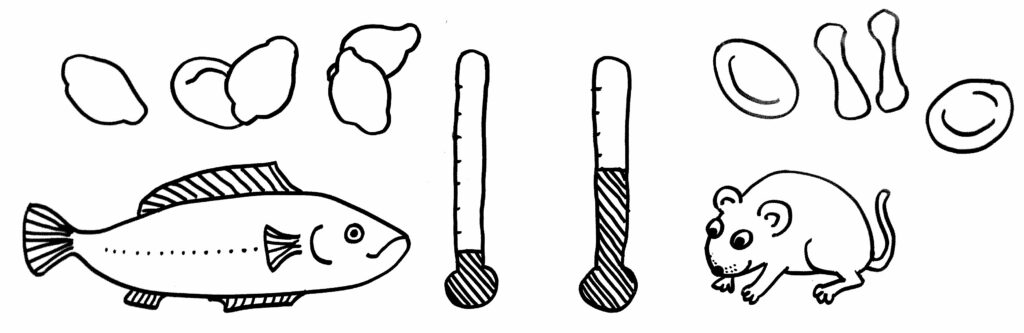
Aber … Moment mal! Was ist denn mit den Vögeln? Auch sie sind gleichwarm, brauchen also meistens viel Energie, um sich gegenüber der Umgebung aufzuheizen. Und ihre roten Blutkörperchen?
 Tja: Die haben trotzdem Zellkerne. Damit fällt die einleuchtende Erklärung für den Kernverlust der Säugetier-Erythrozyten in sich zusammen wie ein Kartenhaus.
Tja: Die haben trotzdem Zellkerne. Damit fällt die einleuchtende Erklärung für den Kernverlust der Säugetier-Erythrozyten in sich zusammen wie ein Kartenhaus.
Nicht immer sind Just-so-Stories so leicht zu erkennen. Wir Menschen haben das Bedürfnis, Dinge zu begreifen, und verspüren oft eine tiefe Befriedigung, wenn wir auf eine nachvollziehbare Erklärung für ein Phänomen stoßen. Im Autoimmunbuch und im Friendly-Fire-Blog bin ich besonders anfällig für Just-so-Stories, denn ich schreibe dies alles ja in erster Linie, um mir selbst und anderen Interessierten unser Immunsystem und die Entstehung von Autoimmunerkrankungen begreiflich zu machen. Denn je besser ich die unheimlichen Entgleisungen meines Immunsystems verstehe, desto weniger ängstigen sie mich. Auch wenn ich skeptisch und wachsam zu bleiben versuche, wird bestimmt die eine oder andere evolutionsbiologische oder ökologische Herleitung im Buch und im Blog schlecht altern. Aber das nehme ich in Kauf.