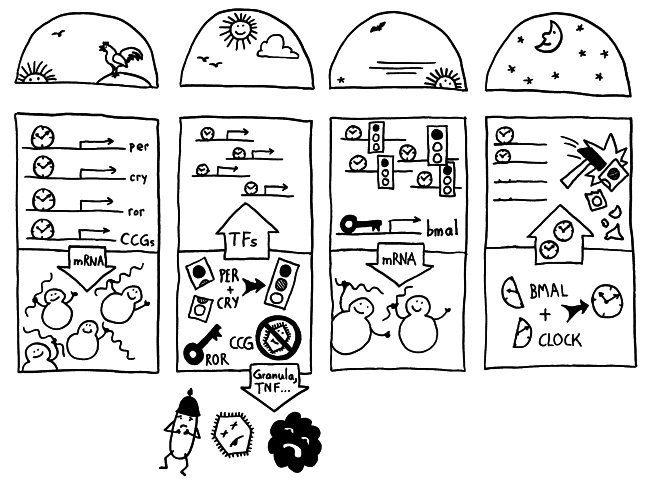
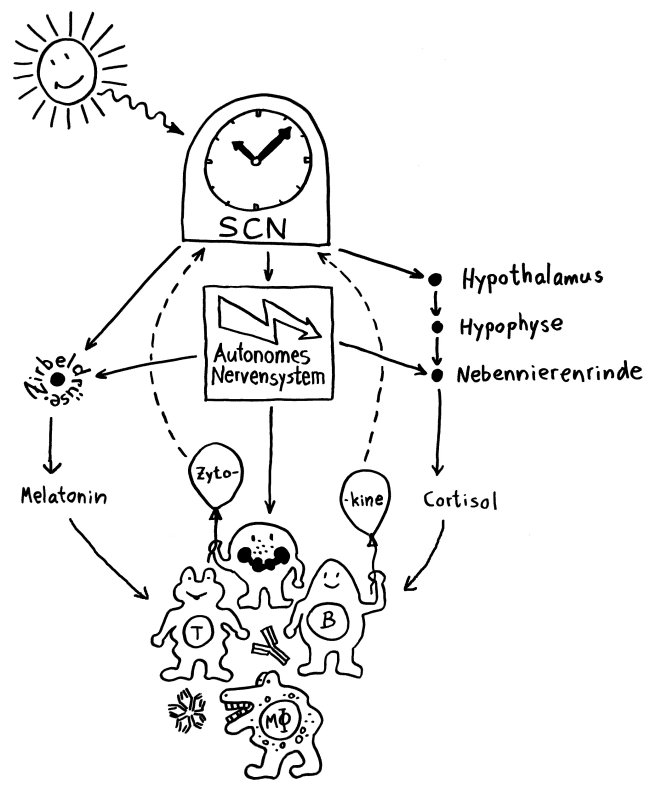
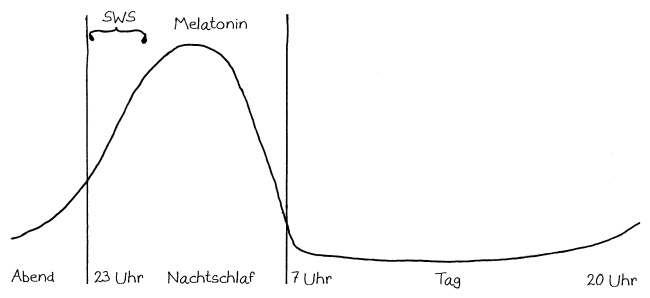
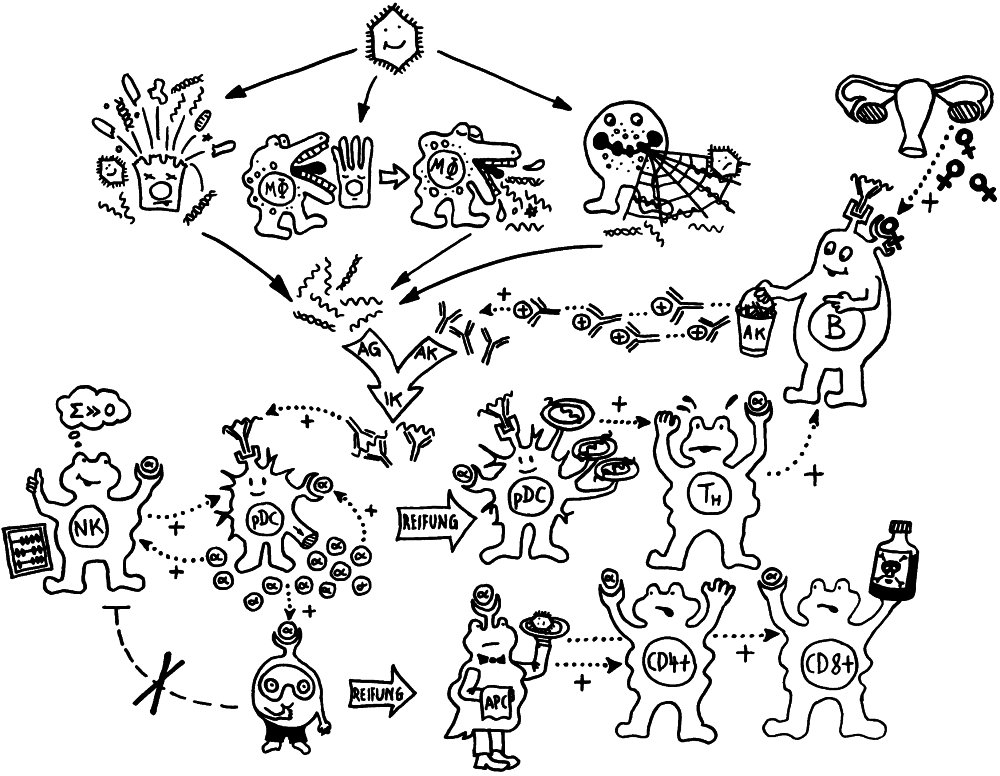
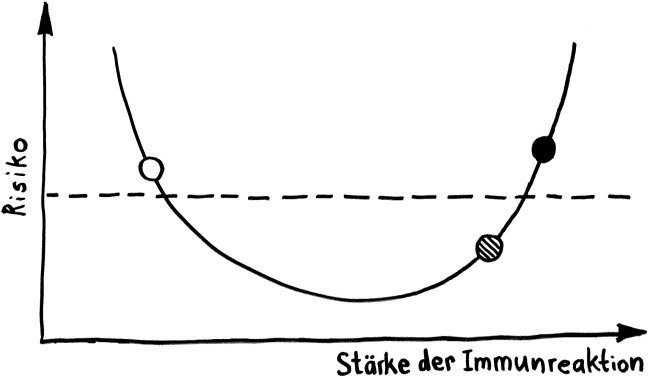
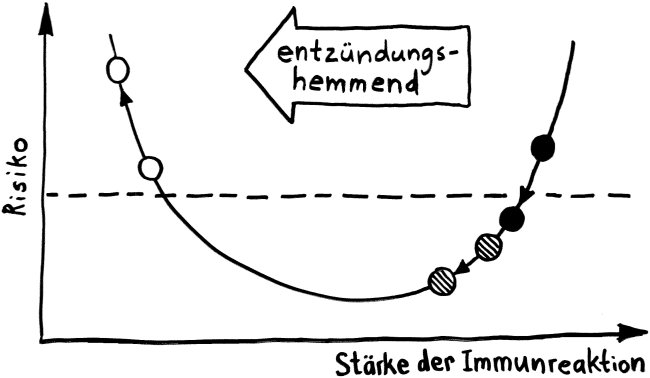
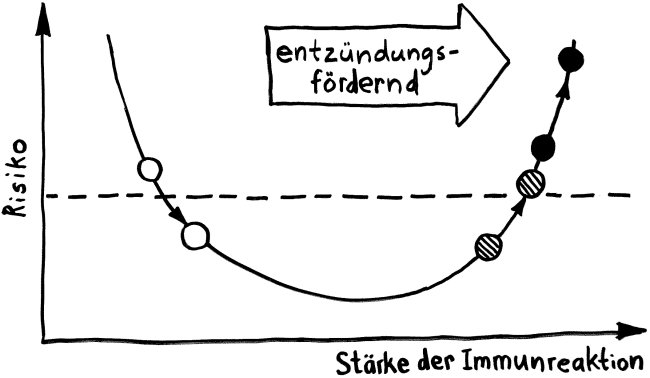
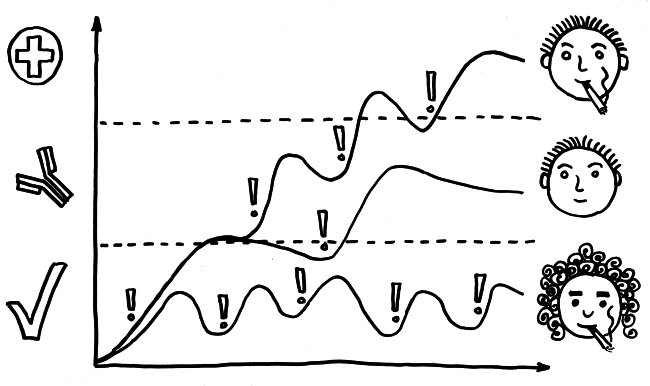
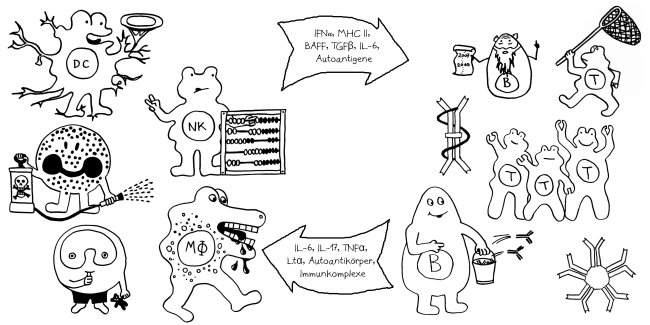
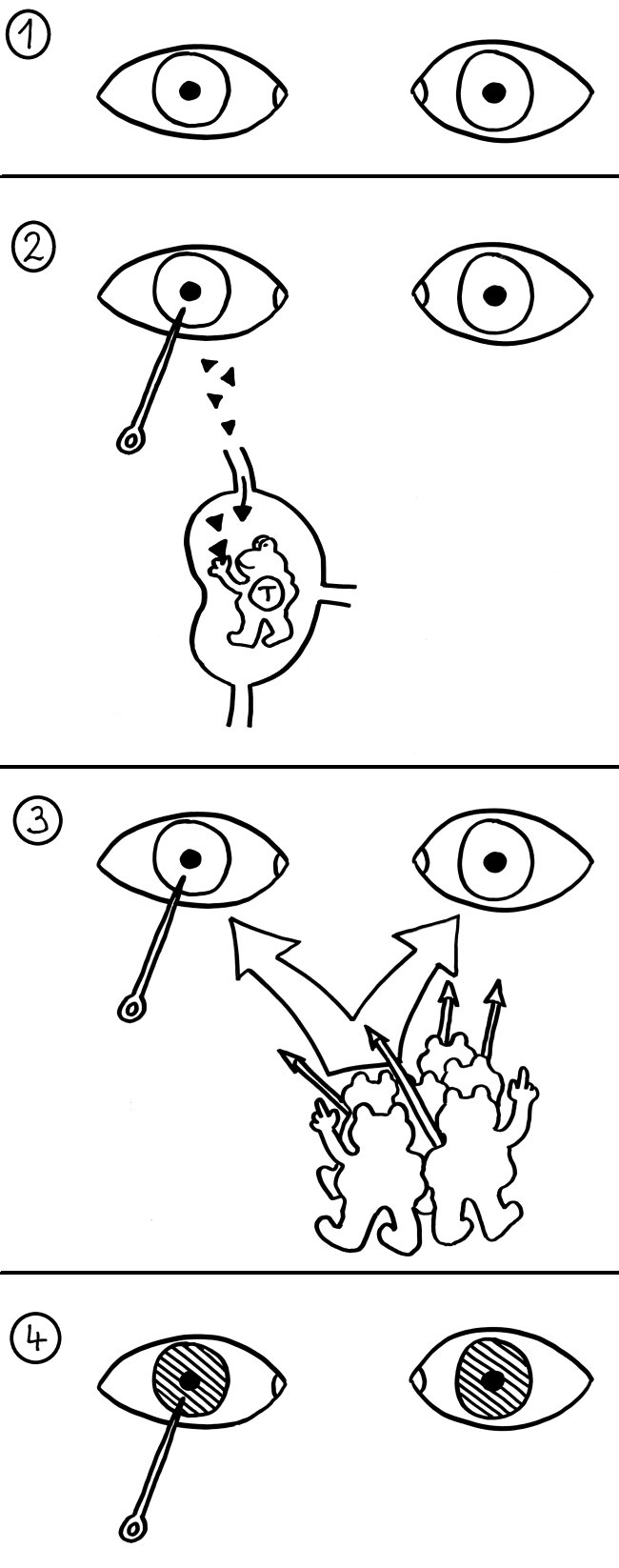
Neben der zentralen biologischen Uhr im Hypothalamus (siehe voriger Beitrag) schwingen auch im restlichen Körper viele Vorgänge im 24-Stunden-Takt. Dank dieser lokalen Uhren, die regelmäßig durch Impulse aus dem SCN synchronisiert werden, können sich die Zellen auf regelmäßig wiederkehrende Situationen einstellen. Natürliche Killerzellen (NK-Zellen) dienen z. B. der Bekämpfung von Pathogenen, die zumeist tagsüber während unserer aktiven Phase in den Körper eindringen.
Die Halbkreise geben die Tageszeit (morgens, mittags, abends, nachts) an. Die obere Hälfte der vier Rechtecke stellt jeweils den Zellkern dar, die untere Hälfte das Zytoplasma, also den Zellbereich außerhalb des Kerns. Die Vorgänge sind extrem vereinfacht dargestellt; tatsächlich gibt es z. B. noch mehr Uhrgene, die der Stabilisierung des Rhythmus dienen.
Morgens werden die Uhrgene per, cry und ror abgelesen: Das Protein BMAL/CLOCK (die Uhr) hat an Sequenzen in deren Promotorbereichen angedockt und fördert so ihre Transkription. Außerdem fördert es die Ablesung zahlreicher anderer Gene, der sogenannten clock-controlled genes oder CCGs – in NK-Zellen zum Beispiel Gene, die für die Pathogenbekämpfung nötig sind. Die Transkriptionsprodukte (sogenannte Messenger-RNA oder mRNA) wandern aus dem Zellkern ins Zytoplasma und werden dort von den Ribosomen in Empfang genommen – den Proteinfabriken, die anhand der Bauanleitung in der mRNA Aminosäuren zu neuen Proteinen zusammensetzen.
Mittags haben die NK-Zellen große Mengen der Proteine hergestellt. Einen Teil davon scheiden die Zellen aus, um Viren, Bakterien und Krebszellen auszuschalten – zum Beispiel Giftstoffe aus ihren Granula (Membranbläschen) oder Botenstoffe wie den Tumornekrosefaktor (TNF). Die Proteine PER und CRY lagern sich dagegen zusammen, werden aktiviert und wandern – genau wie das Protein ROR – in den Zellkern ein. Diese Proteine sind Transkriptionsfaktoren; sie beeinflussen also die Ablesung von Genen – genau wie BMAL/CLOCK.
Abends werden die morgens fleißig transkribierten Gene nicht mehr abgelesen, da das Protein PER/CRY (Ampel) die Aktivierung durch BMAL/CLOCK (Uhr) unterbindet. Der Transkriptionsfaktor ROR hat dagegen an eine Sequenz im Promotor des Gens bmal gebunden und so dessen Ablesung eingeschaltet. Er zieht gewissermaßen die Zelluhr auf; daher der Schlüssel. Die bmal-mRNA wandert ins Zytoplasma und wird dort von Ribosomen in Empfang genommen.
Nachts haben die NK-Zellen so viel BMAL hergestellt, dass es sich mit seinem Gegenpart CLOCK zusammenlagern kann. Das Protein tritt in den Zellkern über und ersetzt dort alte, nicht mehr funktionstüchtige BMAL/CLOCK-Einheiten. PER/CRY hat ausgedient und wird von Enzymkomplexen, sogenannten Proteasomen, abgebaut (Hammer).
Damit schließt sich der Kreis. So werden die gefährlichen Wirkstoffe, deren Herstellung zudem viel Energie verbraucht, jeden Tag „just in time“ produziert: dann, wenn Pathogene in unseren Körper eindringen.
(Abbildung inspiriert durch Logan RW & Sarkar DK, „Circadian nature of immune function“, Molecular and Cellular Endocrinology 349 (2012) 82-90, und Gibbs JE & Ray DW, „The role of the corcadian clock in rheumatoid arthritis“, Arthritis Research & Therapy 2013, 15:205)