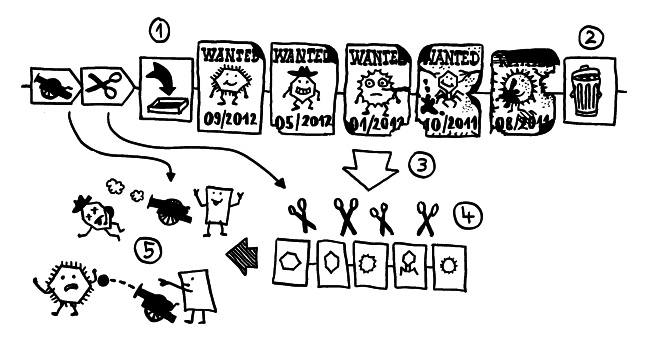
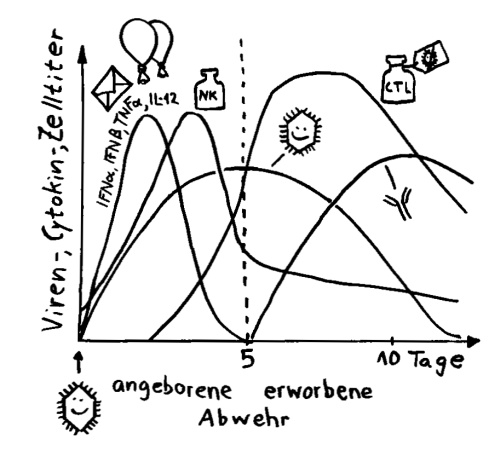
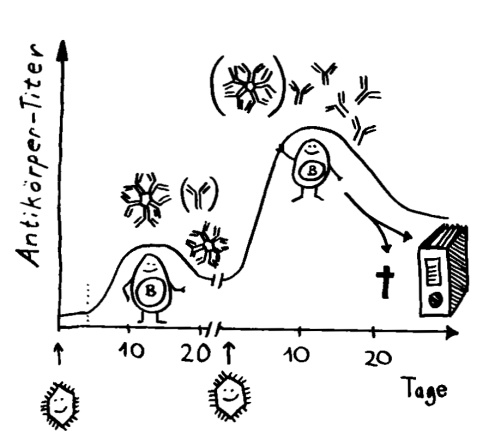
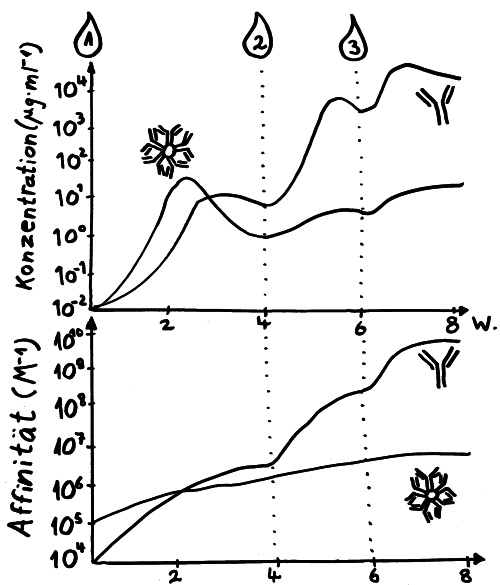
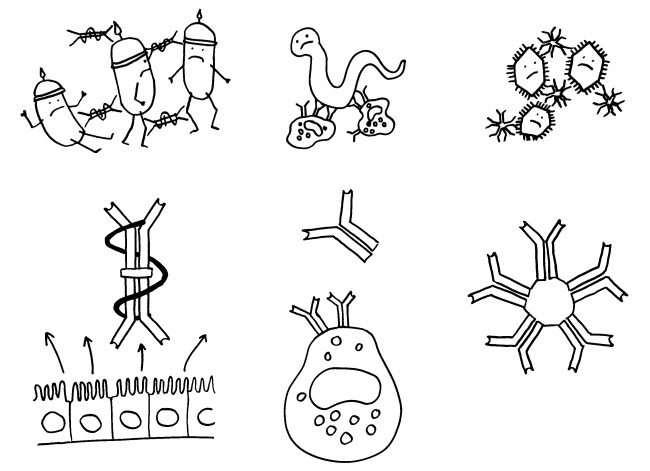
Ich habe meine Fazialislähmung zum Anlass genommen, für das Buch zu skizzieren, wie eine Immunneuropathie abläuft. Zu den Immunneuropathien zählen Autoimmunerkrankungen wie Multiple Sklerose, das Guillain-Barré-Syndrom, chronisch inflammatorische demyelinisierende Polyneuropathie (CIDP) oder vaskulitische Neuropathie. Bei einigen ist das periphere, bei anderen das zentrale Nervensystem betroffen. Oft beschränkt sich die Störung (wie bei der Fazialislähmung) auf einen einzelnen Nerv.
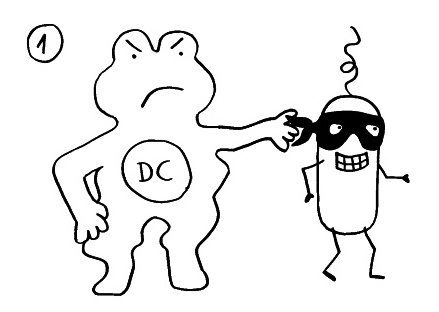
Am Anfang steht vermutlich immer die Reaktivierung eines latenten Virus (z. B. Herpes) oder eine oftmals unbemerkte, da symptomfreie (sogenannte stumme oder maskierte) Infektion, hier durch ein maskiertes Bakterium dargestellt. Eine in der Blutbahn oder im Gewebe patrouillierende Immunzelle – hier eine dendritische Zelle (DC) – entdeckt den Eindringling:
 Die dendritische Zelle nimmt Teile des Erregers auf und verarbeitet sie zu einem präsentablen Antigen weiter. Sie verwandelt sich in eine antigenpräsentierende Zelle (APC), die einer T-Helferzelle das Antigen auf ihrem MHC-Klasse-II-Rezeptor (hier: Tablett) präsentiert. Damit es nicht zu Fehlalarmen kommt, gibt es einen Sicherheitsmechanismus: T-Helferzellen reagieren nur dann auf ein Antigen, wenn ihnen gleichzeitig auf einem anderen Rezeptor ein sogenanntes kostimulierendes Signal präsentiert wird, das anzeigt, dass wirklich eine Infektion oder eine andere Gefahr vorliegt, die bekämpft werden muss (hier: Kerze). Auf der Oberfläche der T-Zelle gibt es für beide Signale spezifische Rezeptoren (hier: Augen/Blickkontakt):
Die dendritische Zelle nimmt Teile des Erregers auf und verarbeitet sie zu einem präsentablen Antigen weiter. Sie verwandelt sich in eine antigenpräsentierende Zelle (APC), die einer T-Helferzelle das Antigen auf ihrem MHC-Klasse-II-Rezeptor (hier: Tablett) präsentiert. Damit es nicht zu Fehlalarmen kommt, gibt es einen Sicherheitsmechanismus: T-Helferzellen reagieren nur dann auf ein Antigen, wenn ihnen gleichzeitig auf einem anderen Rezeptor ein sogenanntes kostimulierendes Signal präsentiert wird, das anzeigt, dass wirklich eine Infektion oder eine andere Gefahr vorliegt, die bekämpft werden muss (hier: Kerze). Auf der Oberfläche der T-Zelle gibt es für beide Signale spezifische Rezeptoren (hier: Augen/Blickkontakt):
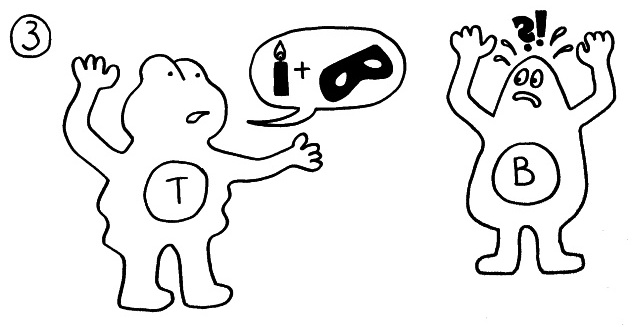
 Die T-Helferzellen reichen die Information über das Vorliegen eines Gefahr (Kerze) und über die genaue Art der Gefahrenquelle, also das Antigen (Augenbinde des Bakteriums), über Rezeptoren und Signalstoffe (Sprechblase) an B-Zellen weiter und regen diese so zur Produktion spezifischer Antikörper an:
Die T-Helferzellen reichen die Information über das Vorliegen eines Gefahr (Kerze) und über die genaue Art der Gefahrenquelle, also das Antigen (Augenbinde des Bakteriums), über Rezeptoren und Signalstoffe (Sprechblase) an B-Zellen weiter und regen diese so zur Produktion spezifischer Antikörper an:
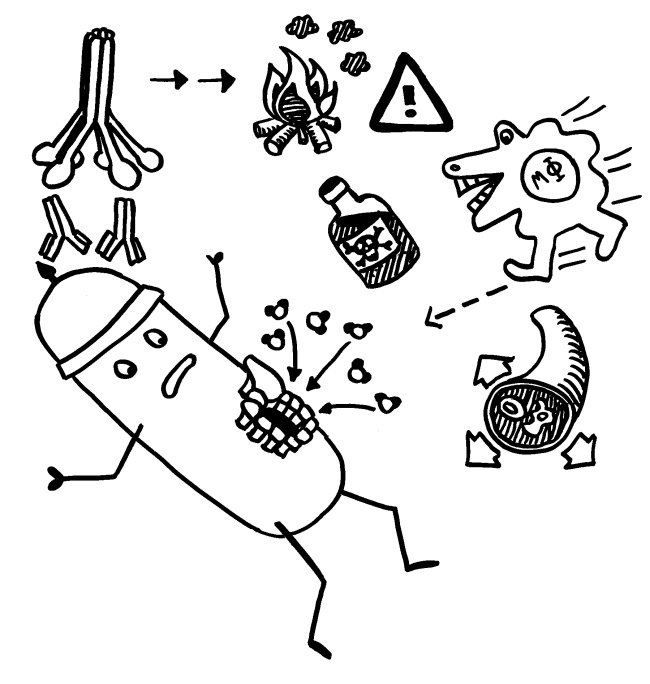
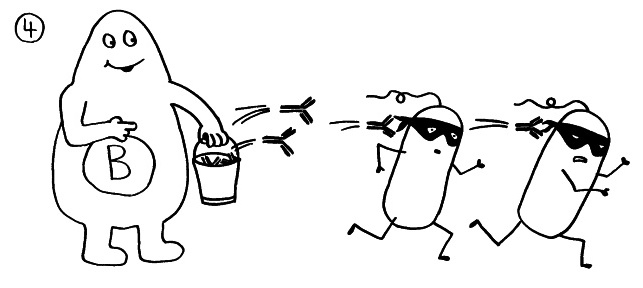
 Die B-Zellen schütten massenhaft Antikörper aus (Eimer), die spezifisch an „ihr“ Antigen binden und die Gefahrenquellen so zum Teil direkt schachmatt setzen, zum Teil zur anschließenden Zerstörung und Entsorgung markieren:
Die B-Zellen schütten massenhaft Antikörper aus (Eimer), die spezifisch an „ihr“ Antigen binden und die Gefahrenquellen so zum Teil direkt schachmatt setzen, zum Teil zur anschließenden Zerstörung und Entsorgung markieren:
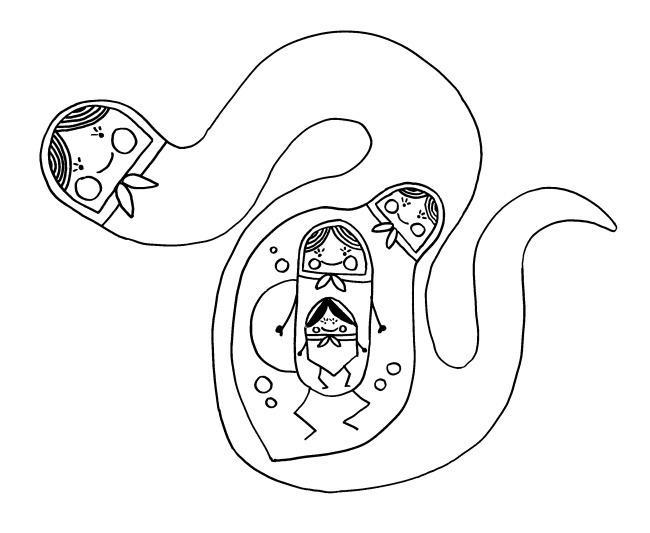
 Diese normale Immunreaktion spielt sich in der Blutbahn, im Lymphgewebe und lokal im infizierten Gewebe ab. Aber manchmal läuft etwas schief: Aktivierte T-Zellen können die Blut-Nerven-Schranke durchdringen und von der Blutbahn (im nächsten Bild links) in einen Nerv (rechts) überwechseln. Das sollte eigentlich nicht passieren, da Nerven zu den sogenannten immunprivilegierten Orten im Körper gehören: Da Entzündungsreaktionen hier viel Schaden anrichten können, sind diese Orte für die meisten Immunzellen tabu. Weiterlesen
Diese normale Immunreaktion spielt sich in der Blutbahn, im Lymphgewebe und lokal im infizierten Gewebe ab. Aber manchmal läuft etwas schief: Aktivierte T-Zellen können die Blut-Nerven-Schranke durchdringen und von der Blutbahn (im nächsten Bild links) in einen Nerv (rechts) überwechseln. Das sollte eigentlich nicht passieren, da Nerven zu den sogenannten immunprivilegierten Orten im Körper gehören: Da Entzündungsreaktionen hier viel Schaden anrichten können, sind diese Orte für die meisten Immunzellen tabu. Weiterlesen