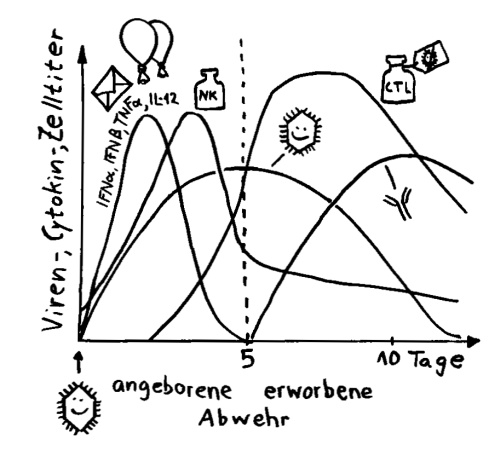
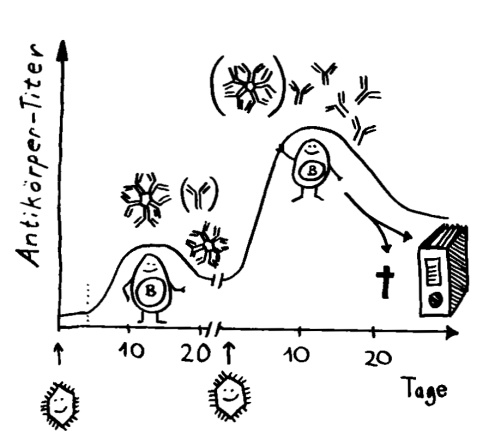
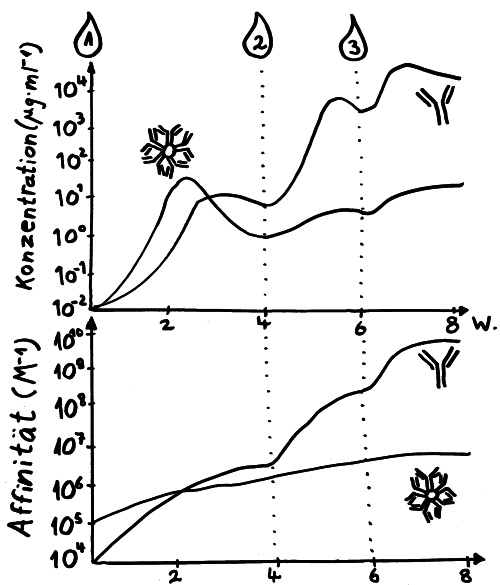
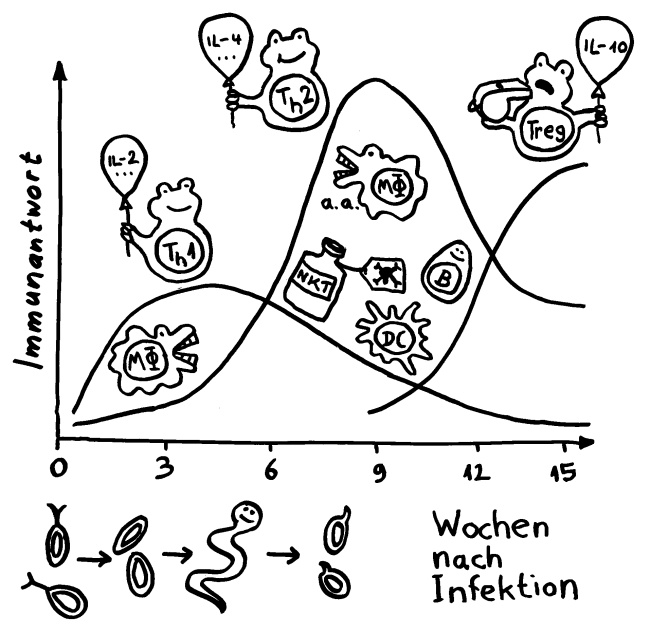
Nach einer Übersetzungspause endlich wieder ein paar Skizzen fürs Buch: Zeitverläufe von Immunisierungen bzw. Infektionen. (Erläuterungen folgen im Buch.)
Komplementsystem und Opsonierung
Skizze fürs Buch – ein bisschen Splatter muss sein: Das Komplementsystem bohrt regelrechte Brunnenlöcher in Bakterien und bringt diese durch eindringendes Wasser zum Platzen.
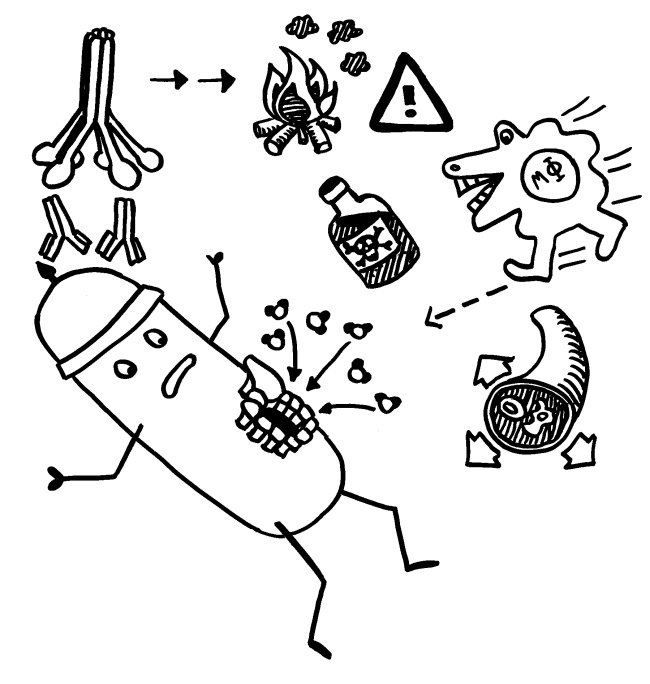 Das Protein C1 bindet an Antikörper, die wiederum an Antigene auf den Pathogenen binden, und löst Reaktionskaskaden aus. In deren Verlauf werden nicht nur die „Brunnenlöcher“ (Membranangriffskomplexe aus C9) gebohrt, sondern auch die kleinen Arterien weitgestellt (schnellerer Transport von Immunzellen zum Ort der Infektion), Histamin aus Mastzellen ausgeschüttet (Botenstoff in der Entzündungsreaktion) sowie Phagozyten (Fresszellen) durch Chemotaxis angelockt und durch die Opsonierung der Pathogene zu deren Verzehr angeregt. Das Komplementsystem gehört zur angeborenen Immunabwehr und wird von vielen Bakterien und Viren durch molekulare Mimikry und Blockaden ausgehebelt.
Das Protein C1 bindet an Antikörper, die wiederum an Antigene auf den Pathogenen binden, und löst Reaktionskaskaden aus. In deren Verlauf werden nicht nur die „Brunnenlöcher“ (Membranangriffskomplexe aus C9) gebohrt, sondern auch die kleinen Arterien weitgestellt (schnellerer Transport von Immunzellen zum Ort der Infektion), Histamin aus Mastzellen ausgeschüttet (Botenstoff in der Entzündungsreaktion) sowie Phagozyten (Fresszellen) durch Chemotaxis angelockt und durch die Opsonierung der Pathogene zu deren Verzehr angeregt. Das Komplementsystem gehört zur angeborenen Immunabwehr und wird von vielen Bakterien und Viren durch molekulare Mimikry und Blockaden ausgehebelt.
Zeitverlauf einer Saugwurminfektion
Die Rote Königin
Nathan Wolfe: Virus. Die Wiederkehr der Seuchen
 Aus dem Englischen von Monika Niehaus. Rowohlt, 2012.
Aus dem Englischen von Monika Niehaus. Rowohlt, 2012.
Ich habe das Buch des Virologen und Direktors der „Global Viral Forecasting Initiative“ bisher gut zur Hälfte gelesen und kann es schon jetzt empfehlen: Es ist spannend geschrieben und von der Biologin Monika Niehaus sehr flüssig und stimmig ins Deutsche übersetzt worden. Der Autor, ein führender Viren- und Seuchenforscher, hat Wichtiges mitzuteilen und betreibt dabei weder Panikmache noch Schönfärberei.
Aus dem 3. Kapitel, „Der genetische Flaschenhals“, habe ich Informationen und Erkenntnisse über die Menschwerdung und den mit ihr verbundenen Wandel unserer Pathogene ziehen können, die ins Autoimmunbuch einfließen werden.
Homing: Wie es weitergeht
Skizzen fürs Buch: Auf das Rollen mit Hilfe der Selektine folgen die Aktivierung durch Zytokine, die Adhäsion mittels Integrinen und die Diapedese, also das Durchdringen des Endothels in Richtung Entzündungsherd.
Rolling home
Die Evolution der Sialinsäure-Gene beim Menschen
Hintergrund/Ergänzungen zum vorigen Artikel über eine Säugetier-Sialinsäure als Xenoautoantigen:
Ajit Varki, Pascal Gagneux: Human-specific evolution of sialic acid targets: Explaining the malignant malaria mystery? PNAS 106(35), 2009, 14739-14740
Plasmodium falciparum verursacht schwere Malaria beim Menschen; nächster Verwandter, P. reichenowi, infiziert Schimpansen und Gorillas, richtet bei ihnen aber weniger Schaden an. Übertragung P. falciparum durch Anopheles-Mücken. Nach Mückenstich infizieren die injizierten Sporozoiten Leberzellen -> Merozoiten, die in die zirkulierenden roten Blutkörperchen (RBCs) eindringen und deren zyklische asexuelle Vermehrung Schübe hohen Fiebers auslösen. P. falciparum exprimiert mehrere Bindungsproteine, die spezifische Ziele auf den RBCs erkennen – vor allem die Sialinsäuren an den Enden der Glykanketten an den Glycophorinen (den häufigsten Oberflächenglykoproteinen) der RBCs.
Das „Sialom“ oder Sialinsäure-Repertoire des Wirts muss sich ständig weiterentwickeln, da die Pathogene schnell evolvieren. Z. B. kam es vor etwa 2-3 Mio. Jahren zu einer Alu-vermittelten Deletion im CMAH-Gen unserer Vorfahren -> keine Biosynthese von Neu5Gc mehr, dafür Akkumulation des Ausgangsstoffes Neu5Ac. Bei den übrigen Menschenaffen kommen beide Sialinsäuren vor. Das wichtigste RBC-Bindungsprotein der Merozoiten von P. falciparum bindet bevorzugt Neu5Ac, das von P. reichenowi bevorzugt Neu5Gc. Der Verlust von Neu5Gc könnte unsere Vorfahren kurzfristig von schwerer Malaria befreit haben. Demnach wäre P. falciparum später entstanden, als das Erkennungsprotein EBA-175 so mutierte, dass es Neu5Ac auf den Erythrozyten erkannte. Vermutlich gab es ein Zwischenstadium, indem EBA-175 beide Formen binden konnte. Weiterlesen
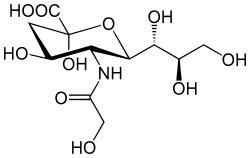
Sialinsäure aus rotem Fleisch: ein Xenoautoantigen
 Notizen zu zwei Artikeln der Arbeitsgruppe um Ajit Varki (Menschwerdung, Coevolution mit Malaria-Erregern usw.), v. a.
Notizen zu zwei Artikeln der Arbeitsgruppe um Ajit Varki (Menschwerdung, Coevolution mit Malaria-Erregern usw.), v. a.
Tho Pham et al.: Evidence for a novel human-specific xeno-auto-antibody response against vascular endothelium. Blood 114(25), 2009, doi: 10.1182/blood-2009-05-220400
Varki 2012: Eine Sialinsäure, die vor allem in rotem Fleisch vorkommt und vom Menschen aufgrund einer Mutation nach der Abspaltung vom Schimpansen-Ast des Stammbaums nicht mehr hergestellt wird, wird bei Fleisch essenden Menschen ins Gewebe (genauer: in die Glycoproteine der Zellmembranen) eingebaut und ruft die Bildung von Xenoautoantikörpern („Fremd-Selbst-Antikörpern“) hervor, die Entzündungen verstärken können.
[Sialinsäuren = N– und O-Derivate der Neuraminsäure (Acylneuraminsäure), bilden oft die Endglieder der Zuckerreste der Glykoproteine auf allen Wirbeltier-Zellmembranen] Weiterlesen
Mikrobiom und Autoimmunerkrankungen, V
Lora V. Hooper et al.: Interactions Between the Microbiota and the Immune System. Science 336(6086), 1268-1273, DOI: 10.1126/science.1223490
(Notizen nur zu den Teilen, in denen es um AIE geht)
In Tiermodellen, in denen Tregs fehlen, fördern Th1- und Th17-Zellen sowie IL-23-abhängige lymphoide Zellen der angeborenen Immunabwehr (innate lymphoid cells = ILCs) Colitis. Vermutlich werden auch beim Menschen CEDs durch ein Ungleichgewicht zwischen den verschiedenen Immunzelltypen ausgelöst, das wiederum von den Kommensalen beeinflusst wird. Dafür sprechen z. B. die starke Kopplung von Morbus Crohn an IL23R-Polymorphismen und von schwerer Enterocolitis an IL10– und IL10R-Mutationen.
Bei keimfrei aufgezogenen Mäusen ist der Verlauf von Arthritis, EAE (MS-Modell) oder Colitis i. A. schwerer als bei Mäusen mit normalem Mikrobiom. Bei Tiermodellen für Th17-abhängige Arthritis und EAE reicht eine Assoziation mit segmentierten filamentösen Bakterien (SFB) aus, um die Krankheit auszulösen. In all diesen Modellen hat die Vermehrung der Th17-Zellen im Darmschleimhaut-Immunsystem systemische Auswirkungen. Die Antigenspezifität dieser Zellen muss noch geklärt werden. Weiterlesen