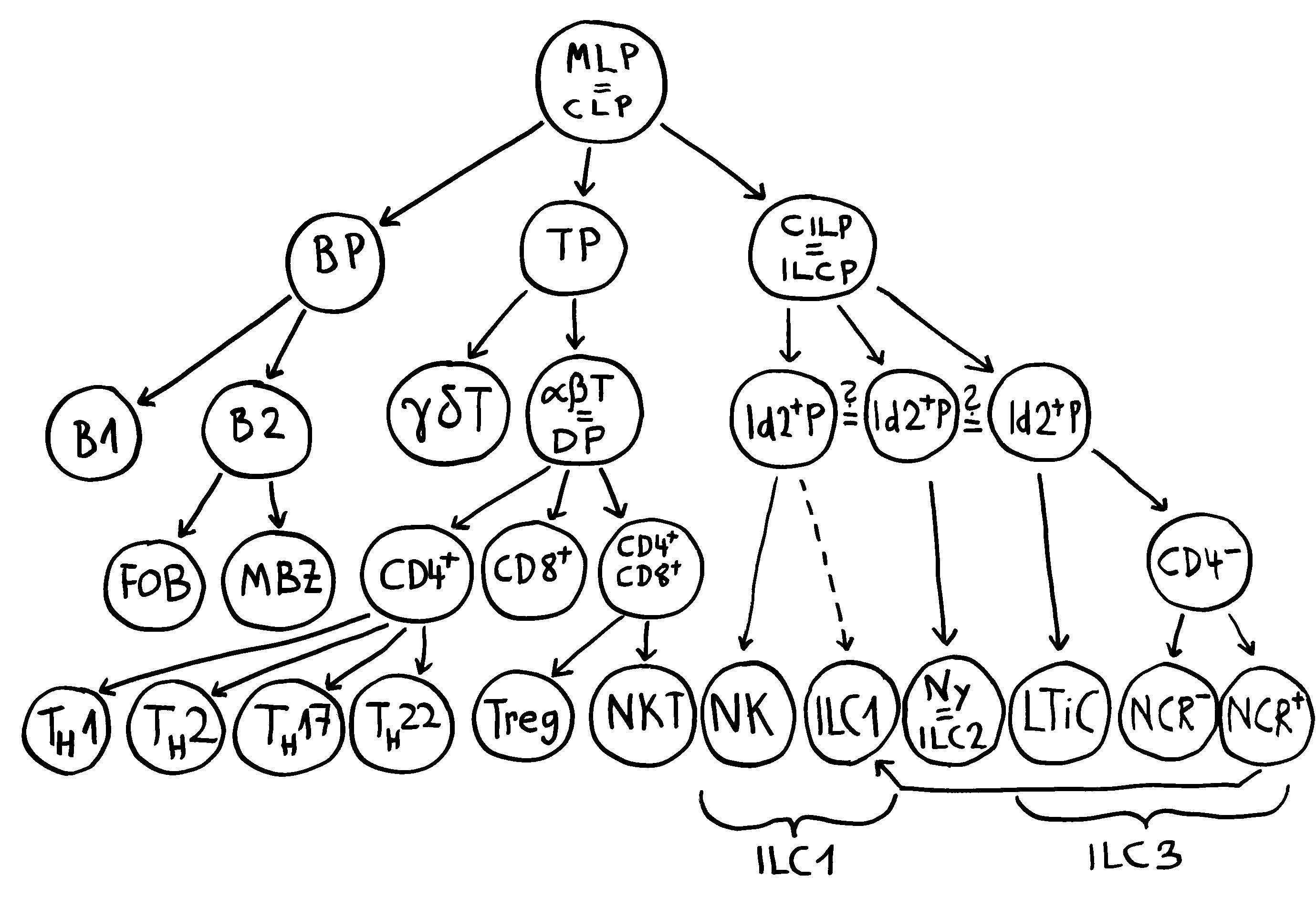
Teil 2 des hämatopoetischen Stammbaums; siehe auch Abb. 105
Nach heutigem Kenntnisstand entstehen aus den multilineage progenitors (MLP), auch common lymphoid progenitors (CLP) genannt, nicht nur die klassischen B- und T-Lymphozyten, sondern auch die innate lymphoid cells (ILCs), die noch keinen etablierten deutschen Namen haben. Aus einem B-Zell-Progenitor (BP) können B1-Zellen, follikuläre B-Zellen (FOB) oder Marginalzonen-B-Zellen (MZB) werden.
Aus einem T-Zell-Progenitor (TP) entwickeln sich entweder Gamma-Delta-T-Zellen (γδT) oder Alpha-Beta-T-Zellen (αβT). Letztere tragen zunächst zwei typische Oberflächenmarker, CD4 und CD8, und heißen daher »doppelt positiv« (DP). Im Thymus reifen sie zu einfach positiven CD4+– oder CD8+– oder aber zu weiterhin doppelt positiven CD4+CD8+-T-Zellen heran. Aus den CD4+-Zellen werden T-Helferzellen des Typs Th1, Th2, Th17 oder Th22. Die CD8+-T-Zellen heißen auch zytotoxische T-Zellen. Aus den doppelt positiven T-Zellen werden entweder regulatorische T-Zellen (Treg) oder natürliche Killer-T-Zellen (NKT).
Die Entwicklungswege der ILCs sind noch nicht ganz aufgeklärt. Natürliche Killerzellen (NK) gehören offenbar zur ILC1-Gruppe. Die nuocytes, die auf Deutsch Nyozyten heißen müssten, sind ILC2-Zellen. Zu den ILC3-Zellen gehören die lymphgewebsinduzierenden Zellen (lymphoid tissue-inducing cells = LTiC) und sowohl eine NCR-negative als auch eine NCR-positive Subpopulation, wobei NCR für natürliche zytotoxische Rezeptoren steht. NCR+-Zellen können sich offenbar zu ILC1-Zellen weiterentwickeln.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de