Ende November stellte mir Rebekka bei Mastodon eine Frage: „Wasn’t this [regulatory T-cells] discovered years ago, and according to my knowledge the Nobel Price is one that is awarded for current achievements?“ Ich habe sie vertrösten müssen, weil ich da aufgrund des Makula-Ödems nach der Netzhaut-Operation noch schlechter am Bildschirm arbeiten konnte als heute. Das Ödem ist m. E. nicht schwächer geworden, aber das Gehirn kann die Verzerrungen mittlerweile wohl etwas besser verarbeiten oder ausblenden. Daher schreib ich noch schnell auf, was ich dazu sagen wollte.
Zufällig sehe ich gerade, dass heute das Video mit den Lectures der drei Preisträger*innen des diesjährigen Nobelpreises für Medizin und Physiologie veröffentlicht wurde. Ich habe es noch nicht angesehen, bette es hier aber ein. Alle drei – Shimon Sakaguchi, Mary E. Brunkow und Fred Ramsdell – kommen nacheinander zur Sprache, und die Abfolge ihrer Vorträge verdeutlicht m. E. gut, was hier geschehen ist:
Rebekka hat recht, dass der Preis nach dem Willen von Alfred Nobel „denen zugeteilt werden [sollte], die im vergangenen Jahr der Menschheit den größten Nutzen geleistet haben“. Das mag um 1900 herum noch funktioniert haben, aber der moderne Wissenschaftsbetrieb funktioniert schon lange nicht mehr so, dass man einen Durchbruch einer einzelnen Person und einem bestimmten Jahr zuordnen könnte. Vielmehr entsteht oft aus Pionierleistungen und zahlreichen Mini-Durchbrüchen vieler Forschungsgruppen über Jahre und Jahrzehnte hinweg ein Gebilde, das irgendwann insgeamt als preiswürdig erscheint.
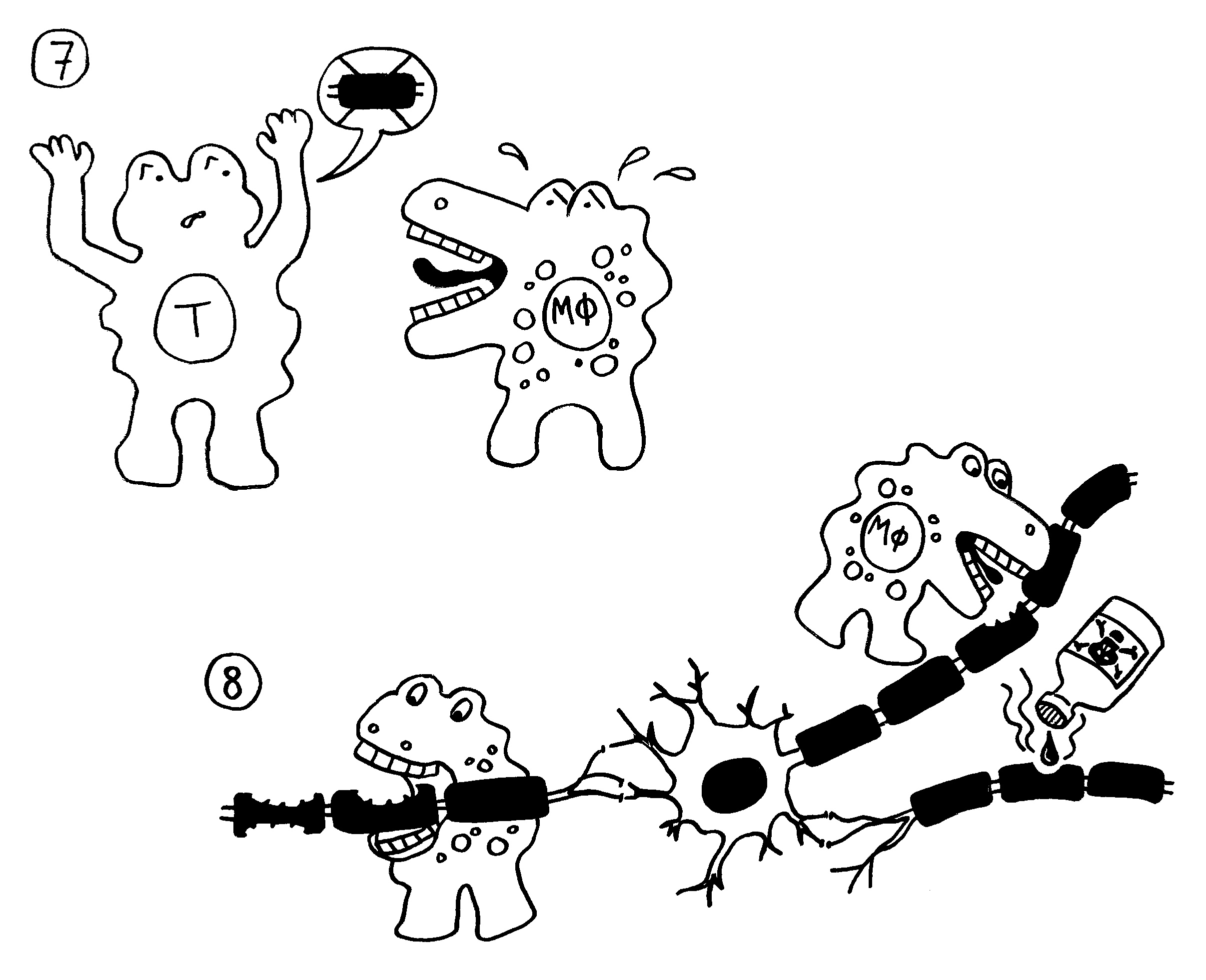
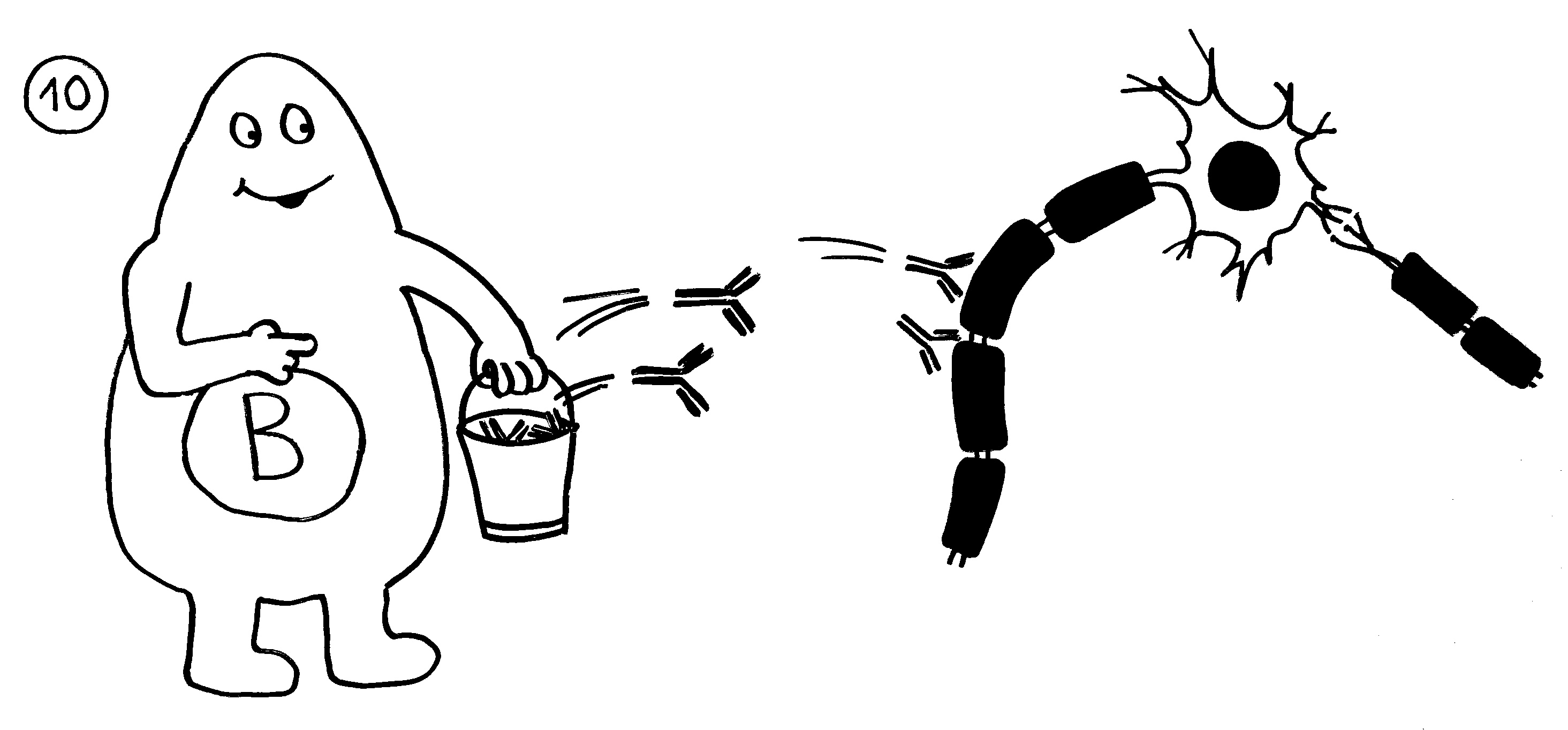
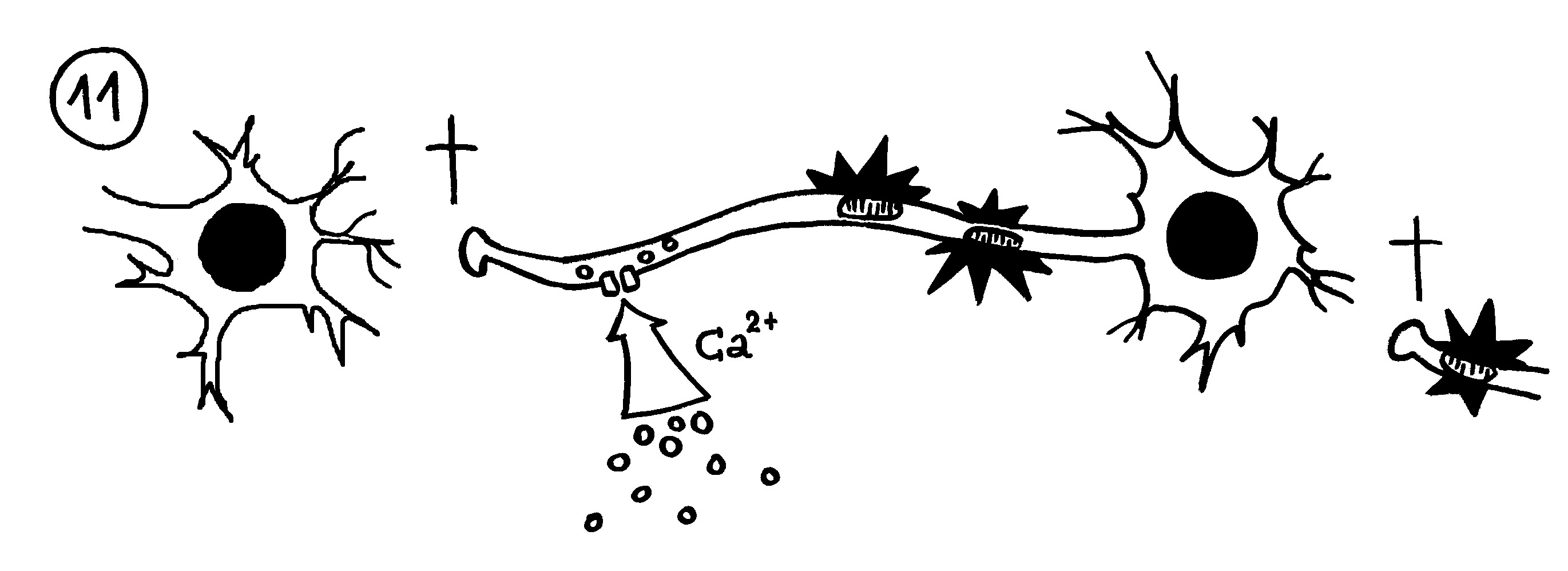
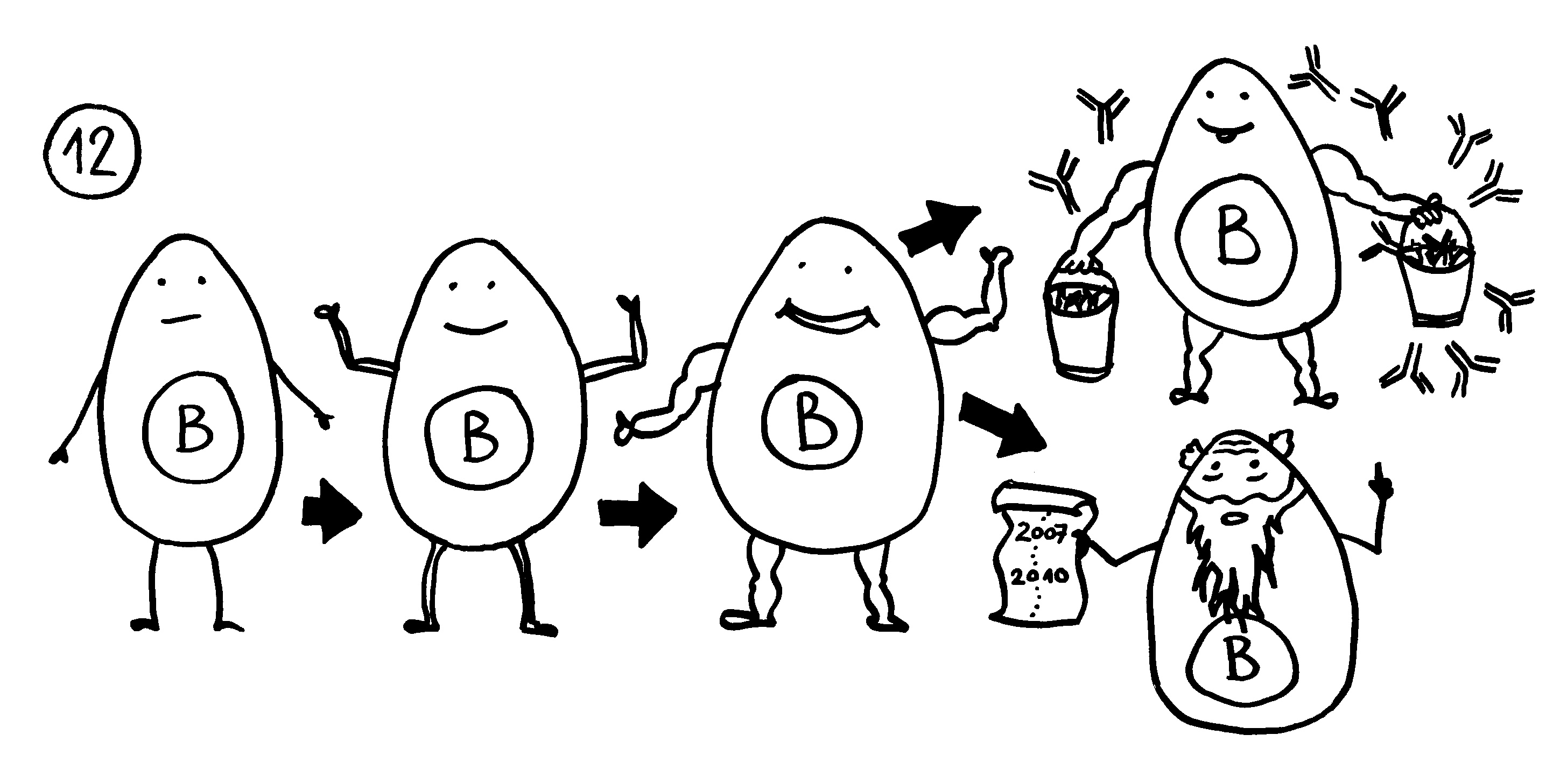
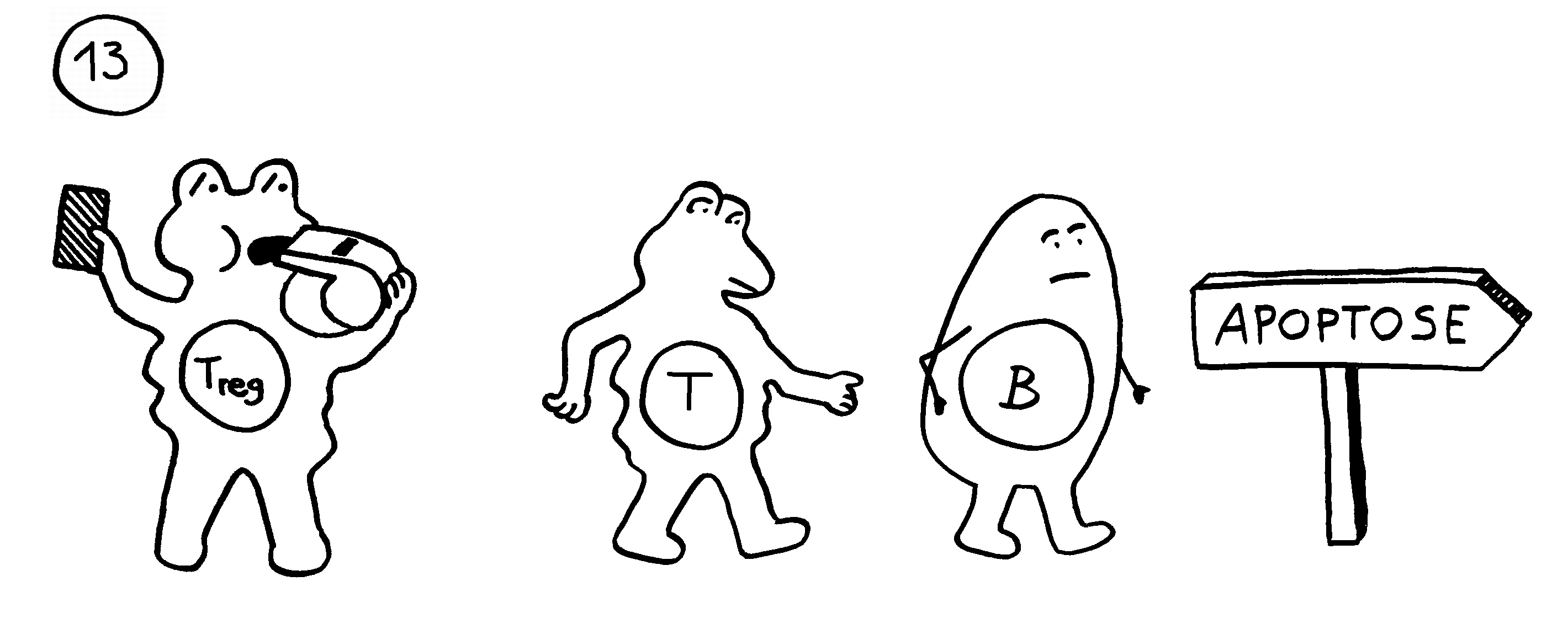
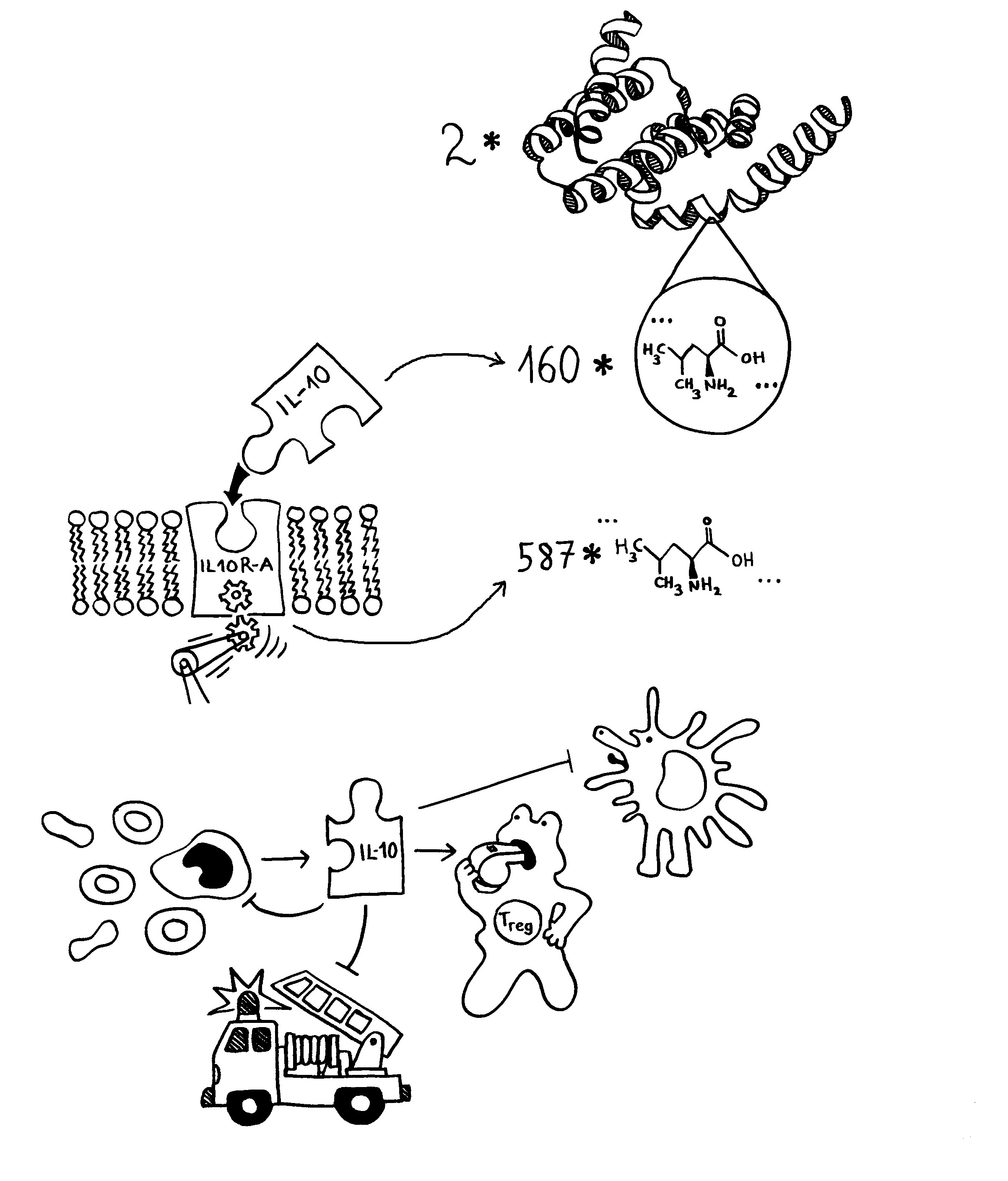
Bei den Tregs hat es allerdings wirklich verdammt lange gedauert: Bekannt sind sie seit den 1970er-Jahren, ihre wichtigsten Marker wurden in den 1990ern identifiziert. Ich habe im März 2011 zum ersten Mal über regulatorische T-Zellen geschrieben – unfassbar, wie lang das her ist. Mein Eindruck ist: Ihre Bedeutung wurde von vielen Immunolog*innen und Mediziner*innen anfangs angezweifelt, teils sogar abgestritten, dann heruntergespielt und schließlich immer stärker anerkannt. Dass es keinen Nobelpreis für einen Durchbruch rund um Tregs gab, wurde irgendwann peinlich.
Heute stehen Tregs an der Schwelle zur klinischen Anwendung bei wichtigen Erkrankungen, die sich durch überschießende Immunreaktionen auszeichnen. Der proof of concept ist erbracht, einige wenige klinische Studien laufen bereits. Da hat man sich wohl gedacht: eine gute zweite Chance, den Preis jetzt zu vergeben – und zwar an drei Personen, die für alle Phasen von der konzeptuellen Pionierarbeit bis zur Anbahnung der Anwendung stehen.
Wie die Treg-Forschung von ihren Anfängen bis heute verlaufen ist, wir in dem Aufsatz „Scientific background 2025. Immune tolerance: The identification of regulatory T cells and FOXP3“ (PDF) zusammengefasst, der auf der Website der Nobelversammlung des Karolinska-Instituts veröffentlicht wurde. Empfehlen kann ich auch den Artikel „Nobelpreis für die Entdeckung der wichtigsten Wächter des Immunsystems„, den Ulrike Gebhardt drüben bei den Riffreportern veröffentlicht hat.