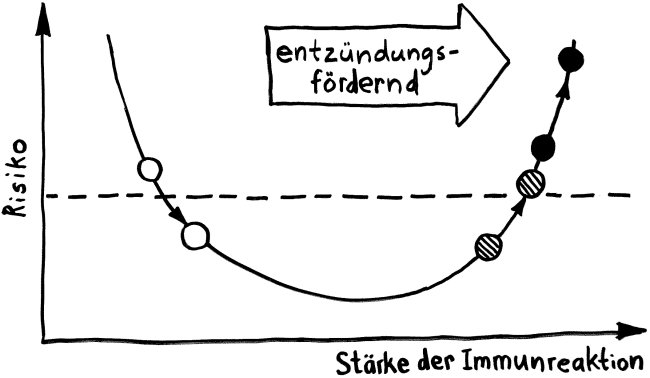
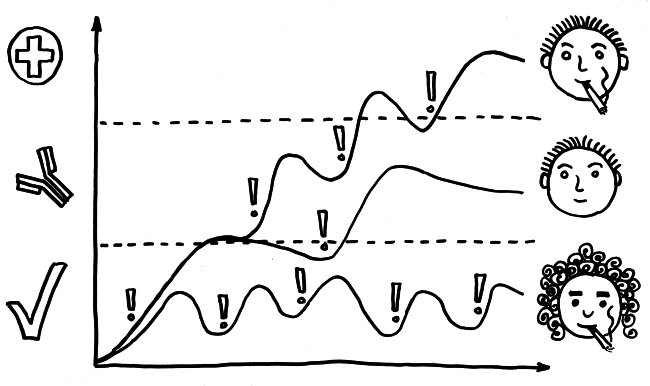
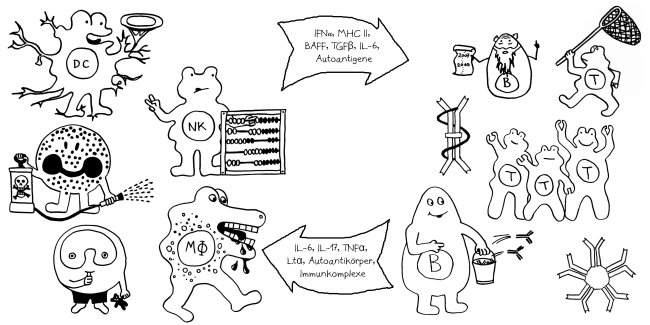
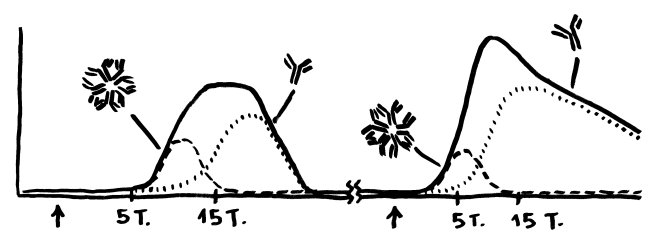
Für die meisten Betroffenen nur ein schwacher Trost, aber evolutionsbiologisch faszinierend: Dass Risikogenvarianten für Autoimmunerkrankungen nicht längst „weggemendelt“ wurden, liegt wohl daran, dass sie mit höheren Überlebenschancen bei Infektionserkrankungen einhergehen.
Für die meisten Betroffenen nur ein schwacher Trost, aber evolutionsbiologisch faszinierend: Dass Risikogenvarianten für Autoimmunerkrankungen nicht längst „weggemendelt“ wurden, liegt wohl daran, dass sie mit höheren Überlebenschancen bei Infektionserkrankungen einhergehen.
So deutet einiges darauf hin, dass manche afrikanische und asiatische Ethnien eine stärkere genetische Neigung zu Lupus (SLE) haben als beispielsweise Europäer, weil eine Variante in einem Gen für einen Rezeptor für das konstante Ende von Antikörpern das Risiko verringert, an Malaria zu sterben – um den Preis eines höheren Lupus-Risikos (Clatworthy et al. 2007).
Eine ähnliche positive Selektion hat wohl der Cholera-Erreger Vibrio cholerae im bengalischen Gangesdelta ausgeübt: Viele Bengalen tragen genetische Varianten in sich, die einerseits die Schlagkraft des angeborenen Arms ihres Immunsystems gegen Cholera, andererseits aber auch die Neigung zu Colitis ulcerosa erhöhen (Karlsson et al. 2013).
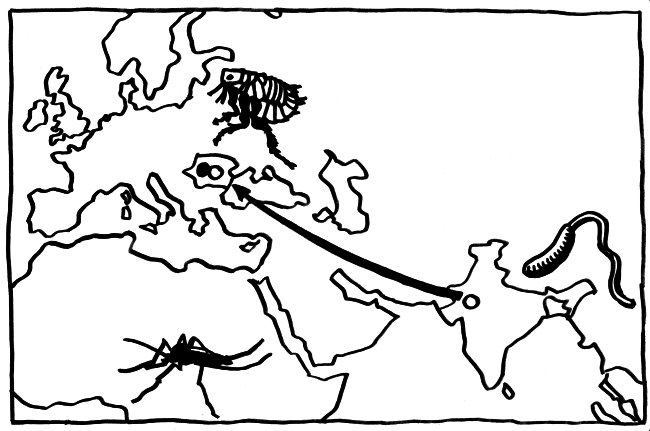
In Europa schließlich dürften die Pestepidemien des Mittelalters und der frühen Neuzeit einen starken Selektionsdruck auf unser Immunsystem ausgeübt haben. Das wird beim Vergleich der Immunsystem-Gene von „alteingesessenen“ Rumänen, rumänischen Roma und Nordwestindern deutlich.
Die Vorfahren der Roma sind zwischen 900 und 1100 n. Chr. aus dem Nordwesten Indiens nach Europa eingewandert (weiße Punkte und Pfeil in der Karte). Seither sind sie in Rumänien im Großen und Ganzen ähnlichen Umweltbedingungen und damit auch einem ähnlichen Selektionsdruck durch Infektionen ausgesetzt wie die übrige Bevölkerung Rumäniens (schwarzer Punkt in der Karte). Sie haben sich aber genetisch kaum vermischt.
Laayouni et al. (2014) haben mehrere Gene für sogenannte toll-like receptors aufgespürt, die in diesen beiden europäischen Populationen in den letzten Jahrhunderten eine konvergente Entwicklung durchlaufen haben: TLR1, TLR6 und TLR10. Kleine Varianten in diesen Genen verändern die Zytokin-Ausschüttung, die durch das Bakterium Yersinia pestis ausgelöst wird. Bei den Nordwestindern, die den Roma genetisch ansonsten noch recht nahe stehen, finden sich diese Varianten nicht – ebenso wenig wie bei den Yoruba in Afrika oder bei den Han-Chinesen.
Unter einem positiven Selektionsdruck stand bei den Rumänen und den Roma offenbar auch eine Variante des Gens ADAMTS12, die das Risiko erhöht, an rheumatoider Arthritis zu erkranken. Etliche TLR-Varianten erhöhen ebenfalls die Neigung zu Autoimmunstörungen oder chronischen Entzündungen.