Spektrum der Wissenschaft, Juli 2012
S. 8, Starkes Immunsystem führt zu Kleinwuchs der Pygmäen: Kurzmeldung auf der Basis einer Arbeit von Sarah Tishkoff und ihrem Team aus PLoS Genetics 8, e1002641, 2012 (Open Access). Pygmäen sind wohl deshalb so klein, weil die genetische Basis der Körpergröße eng mit Genen für die Funktion des Immunsystems gekoppelt ist, vor allem in einem Bereich des Chromosoms 3. Im Lebensraum der Pygmäen herrscht ein enorm hoher Selektionsdruck durch Krankheitserreger, z. B. Malaria- oder Tuberkuloseerreger. Die nötige erhöhte Widerstandsfähigkeit gegen Infektionen ging auf Kosten der Körpergröße. (Wichtig für Teil III meines Buches.)
Biologie in unserer Zeit, 3/2012
S. 152, Axel Brennicke, Innere Uhr. Pflanzen bereiten sich auf den abendlichen Angriff von Insekten vor: Bericht auf der Basis einer Studie von D. Goodspeed et al., Proc Natl Acad Sci USA 2012, 109, 4674 (Closed Access, nur Abstract). Da eine alarmbereite Immunabwehr energetisch kostspielig ist und u. U. auch dem eigenen Gewebe schaden kann, regulieren Pflanzen ihre Abwehrkraft gegen die Raupen im Tagesverlauf je nach voraussichtlicher Gefahrenlage hormonell hinauf oder herab. Abends, wenn die Raupen am meisten fressen, schmecken die Blätter besonders bitter, weil das Hormon Jasmoninsäure, das mittags seine höchste Konzentration erreicht, im Laufe des Nachmittags für eine Anhäufung von Bitterstoffen sorgt. Diese durch die circadiane Uhr der Pflanze gesteuerte Vorsorgemaßnahme wird dann bei den ersten tatsächlichen Bissen von Raupen noch um akute Abwehrmaßnahmen ergänzt. Gegen Schädlinge und Erreger, die in die Pflanze eindringen, um von ihren Nährstoffen zu leben, wirkt ein anderer Arm des pflanzlichen Immunsystems, der durch Salicylsäure gesteuert wird. (Ebenfalls für Teil III meines Buches geeignet.)
S. 174ff, Wolfgang Schumann, Bakterien-Evolution: Das bakterielle Mobilom. Artikel über die Transposons und sonstigen mobilen Elemente, die auf drei Wegen asexuell und horizontal zwischen verschiedenen Baktertien ausgetauscht werden, nämlich Transformation (Aufnahme nackter DNA aus der Umgebung), Konjugation (Übertragung von Plasmiden von einer Donor- auf eine Empfängerzelle, v. a. durch Pili) und Transduktion (Infektion durch Phagen, also Viren, die Bakterien befallen). Das Genom von Escherichia coli kann z. B. zwischen 4,56 und 5,7 Millionen Basenpaare umfassen, weil es mal mehr, mal weniger mobile Elemente enthält. (Ebenfalls für Teil III interessant, gerade i. Zsh. mit der Auswirkung der Umwelt auf die Zusammensetzung unseres Mikrobioms; Bsp.: mikrobielle Porphyranase-Gene im Mikrobiom der japanischen Bevölkerung wg. Verzehr von Rotalgen, s. Kau et al. 2011.)
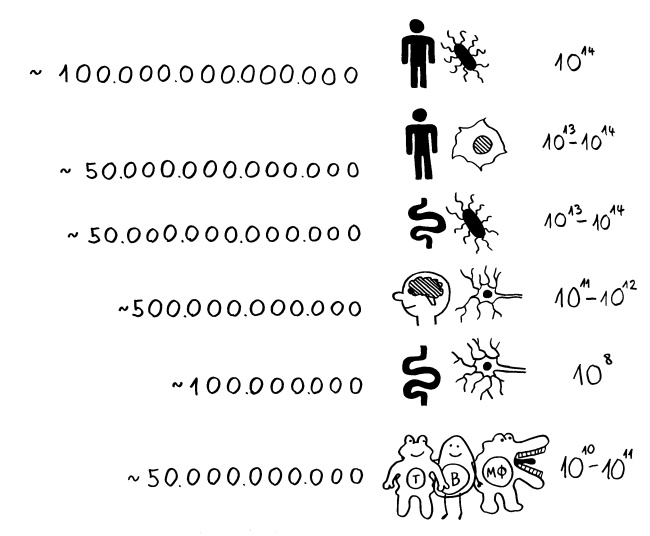 Das sog. Bauchhirn besteht aus etwa 100 Millionen Nervenzellen; es ist nach dem Gehirn mit seinen 100 Milliarden bis 1 Billion Nervenzellen das größte Nervengeflecht im Körper.
Das sog. Bauchhirn besteht aus etwa 100 Millionen Nervenzellen; es ist nach dem Gehirn mit seinen 100 Milliarden bis 1 Billion Nervenzellen das größte Nervengeflecht im Körper.