„Nichts in der Biologie ist sinnvoll außer im Lichte der Evolution“, schrieb der Evolutionsbiologe Theodosius Dobzhansky 1973: Ohne dieses Licht bleibe die Biologie ein Haufen unzusammenhängender Fakten, die kein stimmiges Bild ergeben.
Es lohnt sich, Widersprüchen zwischen Tatsachen und etablierten Vorstellungen nachzuspüren und dabei die Evolution als Richtschnur zu nehmen – also das Wechselspiel von Mutation und Selektion, durch das sich Arten in ihrer Umwelt, aber auch bestimmte Zellpopulationen in unserem Körper entwickeln.
Merkwürdigkeiten
Ein solcher Widerspruch ist Peto’s paradox: 1975 wies der Epidemiologe Richard Peto darauf hin, dass große Säugetiere wie Blauwale oder Elefanten trotz ihrer erheblich höheren Zellzahl und ihrer Langlebigkeit nicht wesentlich früher oder häufiger an Krebs erkranken als kleine, kurzlebige Arten wie Mäuse.
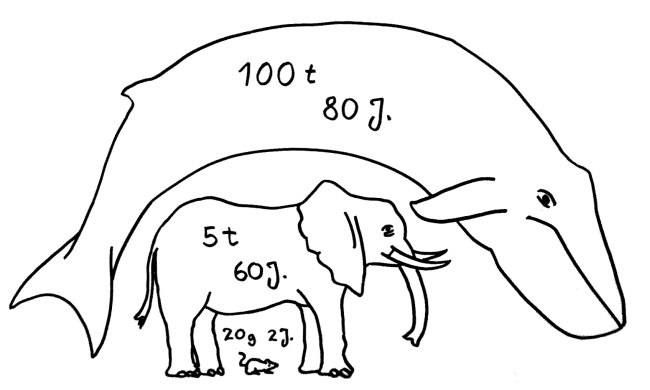
Petos Paradox: Obwohl Wale und Elefanten mehr Zellen haben und älter werden als Mäuse, sterben sie nicht wesentlich öfter an Krebs.
Das passt nicht recht zu dem allgemein akzeptierten Mehrstufenmodell der Krebsentstehung. Nach diesem müsste Krebs nämlich ausbrechen, sobald sich in einer Zell-Linie nacheinander mehrere zufällige Mutationen ereignet haben, die zusammen zu einer unkontrollierten Zellvermehrung führen.
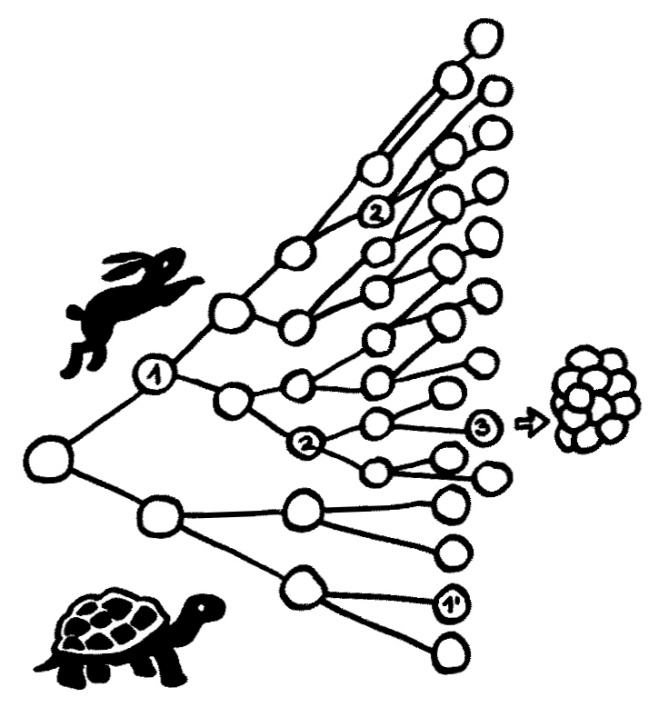
Wenn Krebs ausbricht, sobald bestimmte Mutationen zusammenkommen, müssten Zellen, die sich schneller teilen (oberer Zweig), krebsanfälliger sein. Aber das ist nicht immer der Fall.
Eine zweite Merkwürdigkeit ist der oftmals späte Ausbruch von Krebs beim Menschen, typischerweise nach dem Ende der Reproduktionsphase, und zwar über die meisten Krebsarten und betroffenen Organe hinweg – ob es dort nun viele oder wenige Stammzellen gibt, aus denen die ersten Krebszellen hervorgehen, und ob sich diese Stammzellen nun häufig oder selten teilen. Denn nach dem Mehrstufenmodell müsste Krebs in Organen mit großem Stammzellpool und hohen Zellteilungsraten früher ausbrechen, da sich die tumorbildenden Mutationen dort früher anhäufen sollten – genau wie in größeren Tieren.
Was ist Krebs überhaupt?
Zum besseren Verständnis des Mehrstufenmodells und seiner Unzulänglichkeit blenden wir die beträchtlichen Unterschiede zwischen all den Krebsformen und individuellen Verläufen einmal aus und betrachten das große Ganze: Was ist Krebs?
Wenn im Erbgut einer Zelle etwas schief gelaufen, etwa bei der letzten Zellteilung ein Kopierfehler aufgetreten ist, gibt es mehrere Möglichkeiten. Die DNA kann von Enzymkomplexen im Zellkern repariert werden. Oder die Zelle kann unschädlich gemacht werden – entweder durch einen Ruhestandsmodus namens Seneszenz, in dem sie sich insbesondere nicht weiter teilt, oder durch ein Selbstmordprogramm namens Apoptose, das auch die Beseitigung der Überreste durch Zellen des Immunsystems einschließt.
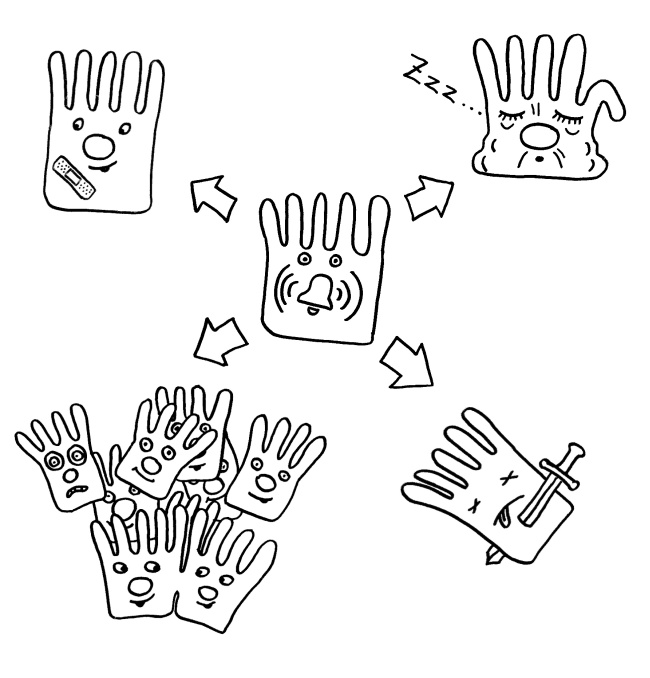
Eine Zelle, in deren Erbgut etwas schief gelaufen ist (Alarm, Mitte), kann entweder repariert werden oder in Seneszenz verfallen oder Selbstmord begehen oder – wenn diese Schutzmechanismen versagen – zur Krebszelle werden.
Versagen diese Mechanismen, teilt sich die defekte Zelle unter Umständen unkontrolliert weiter. So entstehen im Gewebe Tumoren, also bösartige Geschwulste, oder im Fall von Blutzellen Blutkrebs. (Im Folgenden geht es überwiegend um Tumoren.)