Eine aktuelle Arbeit, die genau zu dem Teil des Buches passt, den ich gerade schreibe, nämlich zur Entwicklung des Immunsystems rund um die Geburt:
T. C. Scharschmidt et al.: A Wave of Regulatory T Cells into Neonatal Skin
Mediates Tolerance to Commensal Microbes. Immunity 43, 1011–1021, November 17, 2015, doi: 10.1016/j.immuni.2015.10.016
Dazu auch Anna Azvolinsky: Birth of the Skin Microbiome
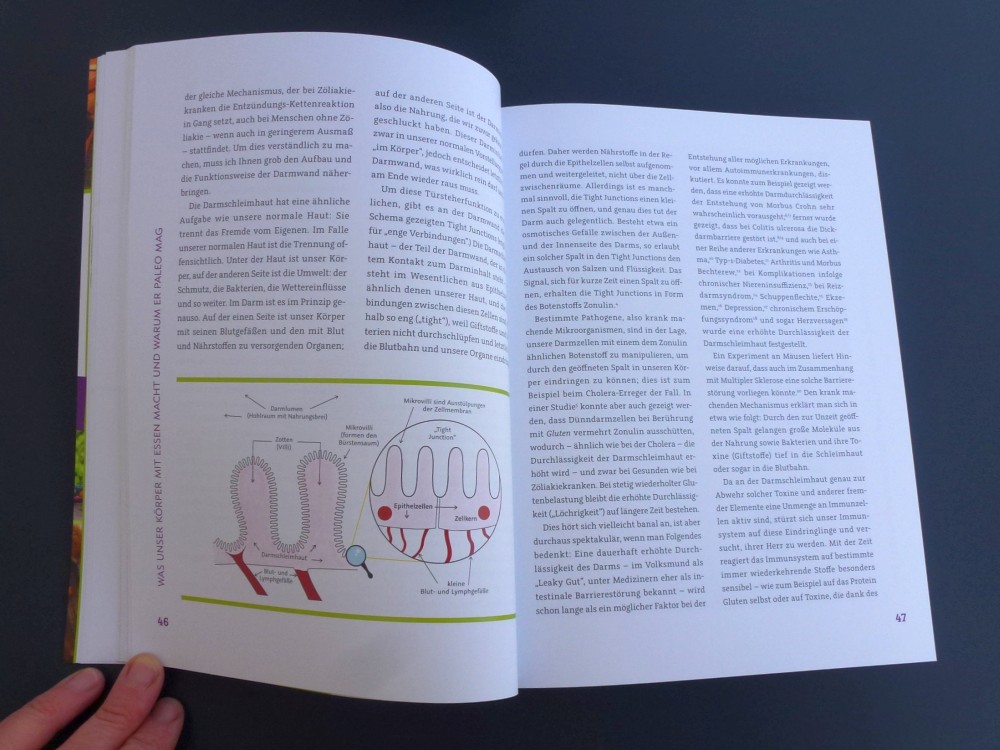
Unsere Haut ist eine der wichtigsten Barrieren zwischen der Außenwelt und unserem Körper und zugleich ein wichtiges Immunorgan. Ein Quadratzentimeter enthält über eine Million Lymphozyten und ist mit etwa einer Million Bakterien besiedelt. Das Mikrobiom der Haut unterscheidet sich grundlegend von der Flora etwa in unserem Darm oder in den Atemwegen, und die Ausbildung der Hautflora ist viel schlechter untersucht als die Etablierung der Darmflora. Unsere Haut ist vielschichtig und enthält zahlreiche Strukturen wie Haarfollikel oder schweiß- und Talgdrüsen, und sie wird im täglichen Leben häufig verletzt, wobei auch Bakterien in die tieferen Schichten eindringen – ohne dort normalerweise Entzündungen auszulösen.
Das kalifornische Forscherteam hat nun an Mäusen untersucht, wann und wie sich die Toleranz des Immunsystems gegenüber dem Bakterium Staphylococcus epidermis ausbildet, einem Kommensalen, der bei Mensch und Maus vorkommt. Bringt man die Bakterien auf die intakte Haut junger, aber ausgewachsener Mäuse auf, so kommt es zu einer gewissen T-Zell-Reaktion, aber nicht zu einer merklichen Entzündung. Kratzt man die Mäuse einige Wochen später und trägt erneut Bakterien auf die nunmehr verletzte Haut auf, so entzündet sie sich, es wandern viele Neutrophile (Zellen der angeborenen Abwehr) in die Haut ein, und die T-Zellen (Zellen der erworbenen Abwehr) reagieren stark auf die Eindringlinge. Das Immunsystem hat also durch den Erstkontakt keine Toleranz ausgebildet.
Anders, wenn man das Experiment mit eine Woche alten Mäusen beginnt, die vier Wochen später gekratzt und erneut mit den Bakterien konfrontiert werden: Bei ihnen werden dann nur wenige T-Zellen aktiv, und die Entzündung fällt sehr schwach aus. Der Organismus ist offenbar gegen Staphylococcus epidermis tolerant geworden. Dafür sind offenbar spezifische regulatorische T-Zellen oder Tregs vonnöten, die vor allem während der zweiten Lebenswoche der Mäuse recht abrupt in die Haut einwandern. Tregs aus dem Thymus sind auch in der Darmschleimhaut notwendig, um das Immunsystem gegen die Darmflora milde zu stimmen. Anders als im Darm beeinflusst die Zahl der Keime auf der Haut aber nicht die Zahl der Tregs.
Über 80 Prozent der CD4+-T-Zellen in der Haut von 1-2 Wochen alten Mäusen sind Tregs, während es bei erwachsenen Mäusen etwa 50 Prozent sind. Ihre Dichte in der Haut ist bei den Baby-Mäusen doppelt so hoch wie bei den ausgewachsenen Tieren, und sie sind hochgradig aktiviert – wiederum im Unterschied zu den Haut-Tregs erwachsener Mäuse. In tiefer liegenden Gewebeschichten kommt es nach der Geburt nicht zu einer Treg-Akkumulation; diese ist also hautspezifisch.
Behandelt man die neugeborenen Mäuse kurz vor dem ersten Auftragen von Staphylococcus epidermis mit einem Rezeptorantagonisten, der spezifisch die Auswanderung von Tregs aus dem Thymus unterbindet, so werden die Mäuse nicht tolerant gegen den Keim: nach dem Aufkratzen der Haut und dem zweiten Kontakt mit den Bakterien reagieren sie mit einer starken Entzündungsreaktion – anders als die Kontrollgruppe, in der die Wanderung der Tregs aus dem Thymus in die Haut nicht unterbunden wurde.
Außerdem enthält die Haut der Tiere mehr für Staphylococcus-Antigene spezifische Effektor-T-Zellen und weiterhin nur wenige für Staphylococcus-Antigene spezifische Tregs, obwohl die migrationshemmende Wirkung des vier Wochen zuvor verabreichten Rezeptorantagoisten längst abgeklungen ist und andere Tregs durchaus in der Haut vorkommen. Die Antigen-spezifischen Tregs müssen also im richtigen Zeitfenster – ein bis zwei Wochen nach der Geburt der Mäuse – aus dem Thymus in die Haut gelangen, um eine Toleranz gegen Kommensalen aus der Hautflora aufzubauen.
Anders als im Darm, in dem sowohl angeborene, direkt aus dem Thymus stammende Tregs (nTregs oder tTregs) als auch in der Peripherie durch Antigen-Präsentation induzierte Tregs (iTregs) an der peripheren Toleranz beteiligt sind, scheinen iTregs in der Haut nicht an der Etablierung der Toleranz gegen Kommensalen beteiligt zu sein – zumindest nicht in diesem frühen Zeitfenster. Auch die Mechanismen, über die Tregs andere Immunzellen tolerant stimmen, unterscheiden sich offenbar: Im Darm spielt das von den Tregs ausgeschüttete, entzündungshemmende Zytokin IL-10 eine große Rolle, während ein IL-10-Mangel das Gleichgewicht in der Haut nicht weiter zu stören scheint.
Auch die abrupte, massive Einwanderung hoch aktiver Tregs und während der zweiten Lebenswoche der Mäuse scheint hautspezifisch zu sein: Im Darm kommt es gar nicht zu einer solchen Welle, und in der Lunge ist sie erstens viel schwächer (Tregs stellen dort höchstens 15 Prozent der CD4+-T-Zellen statt über 80 Prozent) und zweitens offenbar nicht für die Ausbildung der Toleranz gegen Atemwegs-Kommensalen zuständig.
Auffällig ist, dass die Haarfollikel in der Haut der jungen Mäuse genau zur Zeit der Treg-Einwanderung entstehen. Tregs halten sich in der Haut von Mäusen wie Menschen bevorzugt an den Haarfollikeln auf. Vielleicht sondern die entstehenden Follikel ein Chemokin ab, das die Tregs anzieht. Da sich an den Haarwurzeln besonders viele Kommensalen ansiedeln, wäre es evolutionär von Vorteil, wenn auch die periphere Toleranzausbildung vor allem dort stattfände.
Da die Barrierefunktion der Haut nicht nur lokale, sondern (etwa bei der Entstehung von Asthma) auch systemische Auswirkungen hat, sollte man mit allem, was die Ausbildung einer normalen Hautflora und einer Toleranz des Immunsystems gegen diese Kommensalen beeinträchtigen könnte, sehr aufpassen – etwa mit Antibiotika-Behandlungen bei Neugeborenen.