Vor elf Jahren habe ich hier drei Texte zum Verhältnis zwischen Allergien bzw. Asthma und Autoimmunerkrankungen veröffentlicht:
Schließen Autoimmunerkrankungen und Allergien einander aus? Teil 1
Schließen Autoimmunerkrankungen und Allergien einander aus? Teil 2
Schließen Autoimmunerkrankungen und Allergien einander aus? Teil 3
Das durchwachsene Fazit: Einige Autoimmunerkrankungen könnten bei Menschen mit (bestimmten Formen von) Asthma seltener auftreten als bei Menschen ohne Asthma. Andere Studien fanden keine positive oder negative Assoziationen zwischen Asthma oder Allergien auf der einen und verschiedenen Autoimmunerkrankungen auf der anderen Seite.
Die Vorstellung, dass Asthma oder Allergien vor Autoimmunerkrankungen „schützen“, wurde durch das schon damals veraltete Konzept einer einseitigen Dominanz Th1- oder des Th2-Wegs im Immunsystem gefördert, dem zufolge entweder die zelluläre Abwehr (über)aktiv wird oder aber die humorale Abwehr, also die Antikörperproduktuion. Asthma und Allergien wurden mehrheitlich dem Th2-Arm zugeordnet, Autoimmunerkrankungen dem Th1-Arm. Schon 2012 war aber klar, dass Th17-Zellen und regulatorische T-Zellen bei vielen Erkrankungen ebenfalls wichtig sind und dass der Th1- und Th2-Arm einander keineswegs vollständig hemmen: Bei vielen Autoimmunstörungen, die primär durch überaktive T-Effektorzellen (also durch den Th1-Arm) geprägt sind, lassen sich auch hohe Konzentrationen von Autoantikörpern (Th2-Arm) nachweisen – nur ist oft nicht klar, ob sie zum Erkrankungsmechanismus beitragen oder ein reines Epiphänomen darstellen.
Zeit für ein Update! Der Anlass ist eine neue koreanische Studie, in der das Verhältnis von rheumatoider Arthritis (RA), einer von Th1- und Th17-Zellen geprägten Autoimmunerkrankung, zu Asthma bronchiale und anderen chronischen entzündlichen Atemwegserkrankungen untersucht wurde, bei denen Th2-Zellen dominieren:
An der Studie beteiligten sich gut 14.000 Personen über 40 Jahren. Bei ihnen war RA signifikant mit Asthma, allergischer Rhinitis und Sinusitis assoziiert. Die Korrelation war also nicht negativ im Sinne einer Schutzwirkung, sondern positiv: Menschen mit Asthma hatten z. B. mit einer gut doppelt so hohen Wahrscheinlichkeit auch RA wie Menschen ohne Asthma. Das Studiendesign erlaubte zwar keine Aussagen über die Richtung des Zusammenhangs, aber da Asthma und Allergien oft bereits in jungen Jahren auftreten, Rheuma aber erst spät im Leben, liegt es nahe, dass Asthma und Allergien Risikofaktoren für Rheuma sind und nicht umgekehrt. Es gibt auch Längsschnittstudien, die darauf hindeuten.
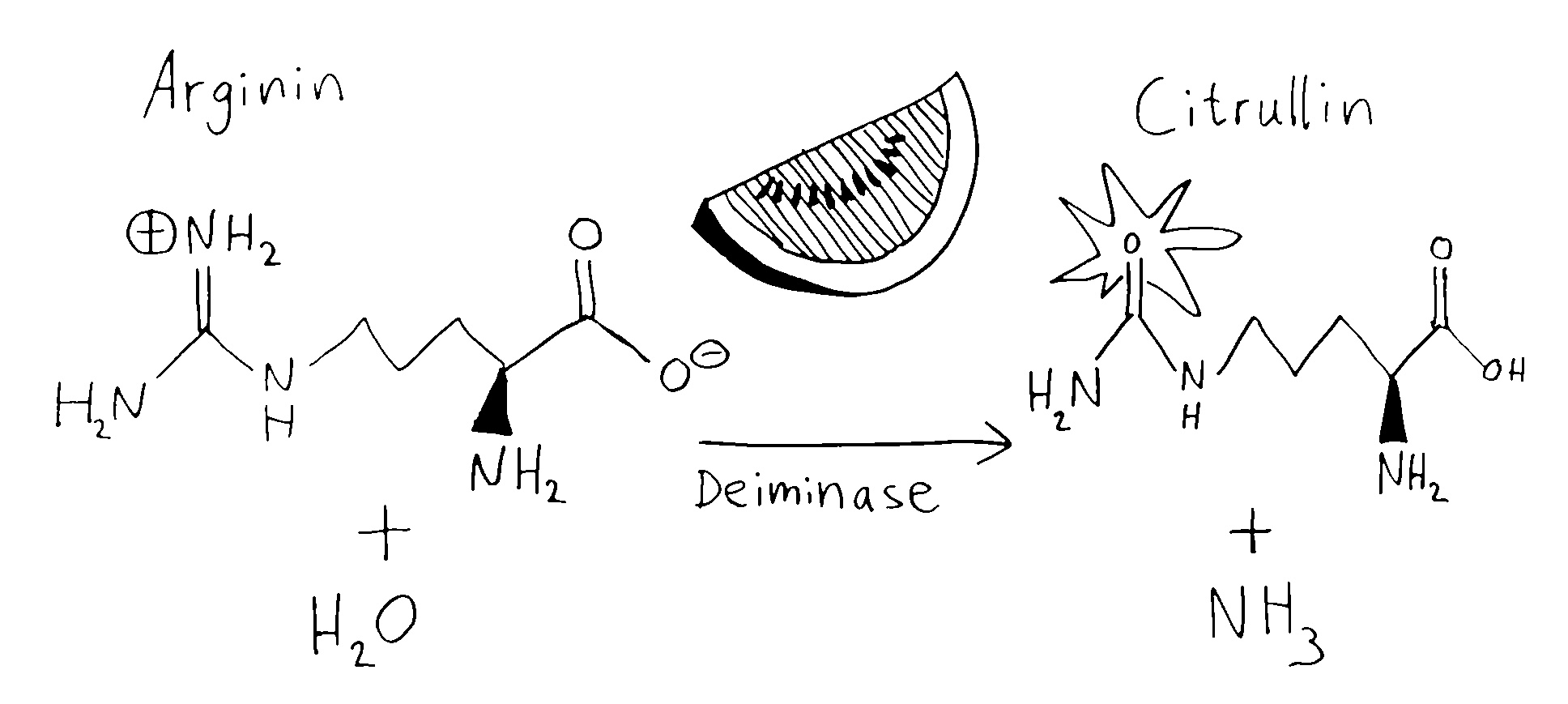
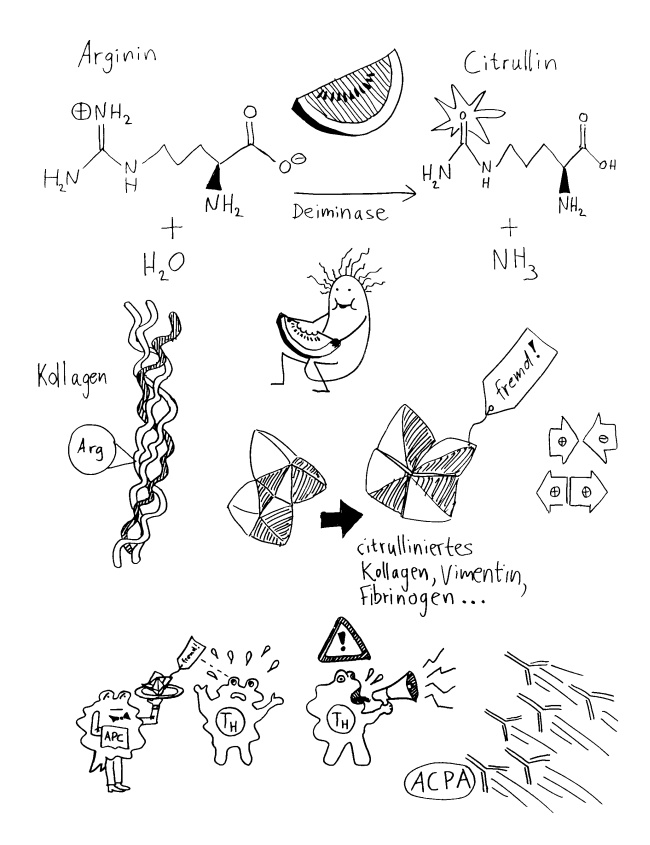
Neu gegenüber den Untersuchungen, die ich 2012 vorgestellt habe, ist der vorgeschlagene Mechanismus hinter diesem Zusammenhang: Schleimhautentzündungen in den Atemwegen erhöhen die sogenannte Citrullinierung. Bei dieser enzymatischen Reaktion wird die Aminosäure Arginin, die in unseren Proteinen vorkommt, in die ähnliche Aminosäure Citrullin umgewandelt, die der menschliche Körper normalerweise nicht herstellt. Diese kleine Modifikation kann dazu führen, dass ein Protein eine etwas andere Faltungskonfiguration einnimmt und daher dem Immunsystem fremd vorkommt. So kann eine Autoimmunreaktion ausgelöst werden, die sich gegen ein körpereigenes Protein richtet. Das scheint bei seropositivem Rheuma der Fall zu sein – siehe Abbildung 111 und Abbildung 231 aus Band 1 des Autoimmunbuchs sowie meine Zusammenfassungen der Arbeiten von Wegner et al. und Routsias et al. Auch Asthma verstärkt die Citrullinierung, und Asthma-Patient*innen haben mehr Antikörper gegen citrullinierte Proteine im Blut als Menchen ohne Asthma.
Wo ich schon dabei war, habe ich auch noch die Abstracts zweier weiterer Veröffentlichungen ausgewertet:
Eine Metaanalyse von Kohortenstudien zeigt, dass Patient*innen mit Asthma ein etwa um den Faktor 1,4 (signifikant) erhöhtes Risiko haben, an RA zu erkranken. Auch eine Metaanalyse von Fall-Kontroll-Studien zeigt ein etwa um den Faktor 1,3 erhöhtes Risiko.
Atopische Dermatitis oder Neurodermitis ist ein gutes Beispiel für die Unzulänglichkeit des alten Th1-versus-Th2-Paradigmas: Die Erkrankung beginnt mit einer Dominanz von Th2-Helferzellen, die die IgE-Antikörper-Produktion fördern, und geht dann zu einer Th1-Dominanz über.
In dieser Studie ist die Richtung klar: Patient*innen mit Rheuma haben kein signifikant erhöhtes Risiko, auch atopische Dermatitis zu bekommen. Umgekehrt geht eine atopische Dermatitis aber wohl mit einem höheren Risik einher, auch an Rheuma zu erkranken. Bei anderen Formen von Arthritis zeigten sich keine klaren Zusammenhänge.
Da die atopische Dermatitis durch häufige Entzündungen der Haut geprägt ist, könnte auch hier die Citrullinierung eines Proteins in der Haut das Bindeglied zum Rheuma sein. Das ist aber Spekulation meinerseits; es geht nicht aus dem Abstract hervor.