Methicillin-resistenter Stamm des Bakteriums Staphylococcus aureus
Teil 1 – Teil 2 – Teil 3
Notizen/Exzerpte
Kapitel 5: Die andere Seite des Wettrüstens
Strategien der Pathogene: per Mutation und Selektion die Abwehr der Wirte ausschalten, also den Rezeptoren entwischen, den Signalweg stören oder dem terminalen Effektor entkommen. Oft kann Pathogen seine Fitness durch Mäßigung der Virulenz erhöhen, damit es länger in einem Wirt bleiben kann. Bsp.: Myxomatose in australischen Kaninchen. Ursprünglich tötete eingeführtes Virus 99,5% der Kaninchen, im Mittel in 11 Tagen. Durchgesetzt hat sich Mutante, die zu 90% tötet und dafür im Mittel 23 Tage braucht. Bsp. für Kompromiss: Wasserfloh Daphia magna und im Verdauungstrakt lebendes pathogenes Bakterium Pasteuria ramosa: Polymorphe Resistenzallele und polymorphe Virulenzallele -> dynamisches Gleichgewicht = negativ häufigkeitsabhängige Selektion; kein Bakterienstamm kann alle Wasserflöhe in einer Population befallen, kein Wasserfloh ist gegen alle Stämme resistent. Bsp. für trojanische Pferde/Zombies, um Hauptwirte zu infizieren: Toxoplasma gondii manipuliert Mäuseverhalten, um in Katzen zu gelangen; auch viele Bsp. im Insektenreich (parasitoide Wespen machen mit Viren-Hilfe Raupen zu Wächter-Zombies …). Bsp. Amöben, domestiziertes Mavirus und Mimivirus: s. Teil 1.
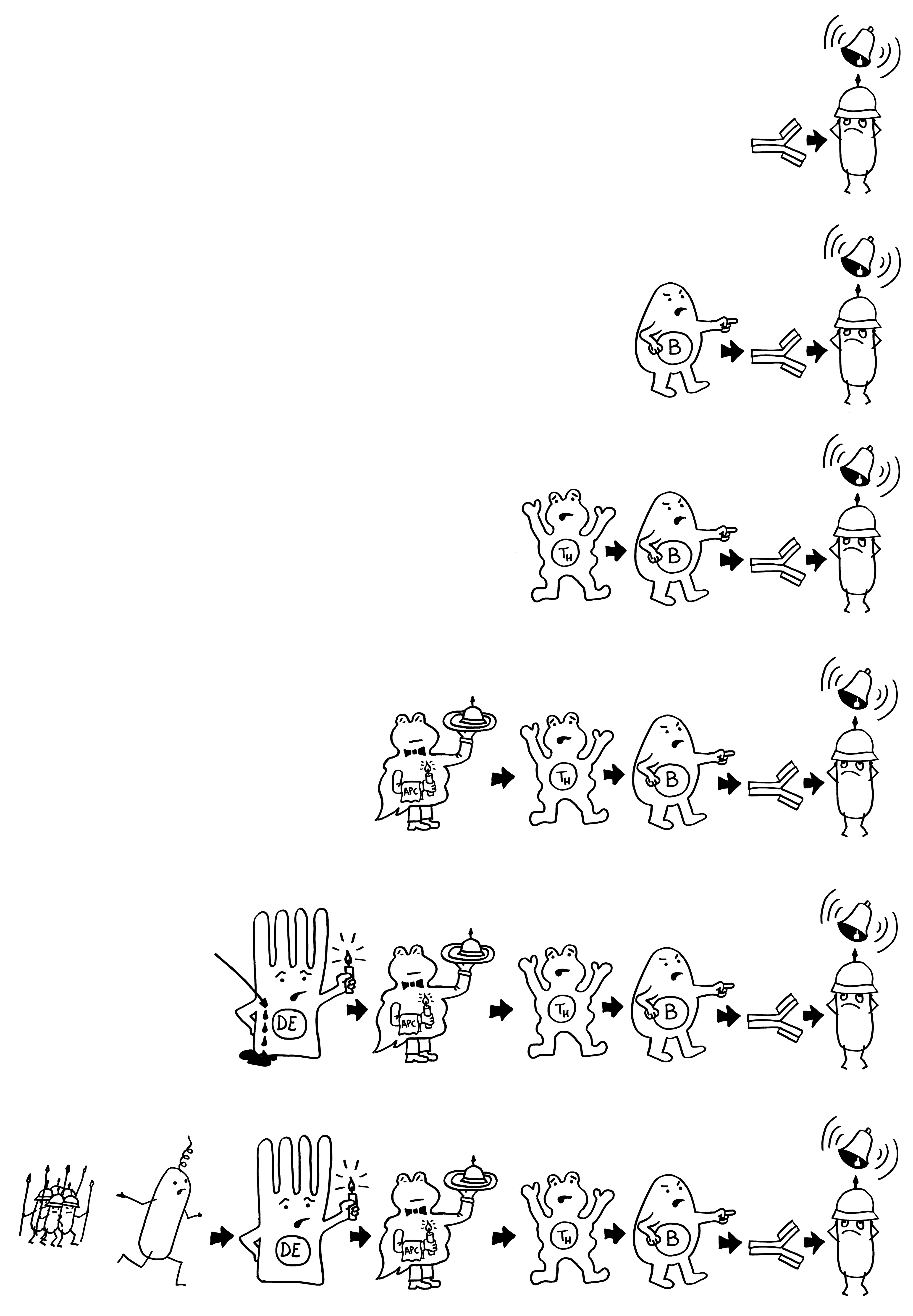
Strategien gg. angeborene Abwehr: 1. unsichtbar machen für Rezeptoren, z. B. durch Polysaccharidkapsel. Verlust der Kapsel beseitigt oder reduziert Pathogenität. Kapsel schränkt aber auch Virulenzmechanismen durch ggs. Abschirmung ein. Yersinia pestis verursacht Beulen- und Lungenpest mit sehr unterschiedlichem R0, hat zahlreiche Virulenzfaktoren, darunter strukturell verändertes Lipid-A in LPS durch temperaturabhängige Acyltransferase: Flöhe 26 °C -> normal -> Hexa-Acyl-Lipid A; Menschen 37 °C -> Enzym inaktiv -> Tetra-Acyl-Lipid-A, das TLR-4 nicht aktiviert -> Zeitgewinn. Auch Helicobacter pylori beherrscht den Trick, Hexa- in Tetra-A. umzuwandeln. 2. Praktisch alle Signalwege von Rezeptoren zu Effektoren wurden von irgendeinem Pathogen gehackt. 3. Effektoren ausschalten: z. B. Phagozytose: Listeria monocytogenes löst Endosom-Membran und flieht ins Cytosol, Salmonella manipuliert mit Mediatoren Zellskelett (MT) und repliziert in Endosomen; ist dort vor Lysosomen und Cytosol-Rezeptoren geschützt. Zellen versuchen die Bakterien auszuhungern, Salmonellen scheiden Siderophoren aus, um dennoch an divalente Metallionen heranzukommen.
Strategien gg. adaptive Abwehr: HIV, HCMV (Humanes Cytomegalovirus), Mycobacterium tuberculosis oder Trypanosoma brucei entkommen ihr durch 1. brute force, 2. Totstellen oder 3. ständige Veränderung. 1. HIV vernichtet direkt die aktivierten CD4+-T-Zellen, HCMV reduziert Wirksamkeit der CD8+-T-Killerzellen. NK-Zellen als Backup aus dr angeborenen Abwehr, Missing self – aber HCMV exprimiert auf Oberfläche infizierter Zellen Moleküle, die MHC-Klasse-I-Molekülen sehr ähnlich sehen – usw. usf. 2. Latente Infektionen, ebenfalls bei HIV und HCMV. Tuberkulose: größter bakterieller Killer der Menschheit; etwa 90% der Infizierten bleiben symptomfrei. Makrophagen können die Bakterien nicht vertilgen, kapseln sie zusammen mit T-Zellen in Granulomen aus Bindegewebe ein. In deren Mitte gibt es praktisch keinen Sauerstoff, fast nur tote Zellen. M. tuberculosis kann in äußerst feindseliger Umwelt „schlafend“ überleben; ein paar aktive Bakterien verlassen als Scouts die Granulome. Sobald Wirt z. B. durch HIV-Infektion geschwächt ist, erwachen sie. 3. HIV: Hypermutation während reverser Transkription. Schlafkrankheit: Trypanosomen von Tsetsefliegen übertragen, sind im Blut von variablen Oberflächen-Glycoproteinen (VSG) bedeckt. Immunsystem sieht nur Spitzen dieser Fäden, die schlechtes Ziel sind. Die VSG werden im Fließbandverfahren so schnell von vorne nach hinten transportiert und am Flagellum recycelt, dass jedes Molekül, das von einem angeborenen Rezeptor erkannt wurde, nach spätestens 120 Sekunden verschwunden ist. Zwar sind VSG hervorragende Antigene, sodass sie viele Antikörper hervorrufen, aber ein paar Bakterien entkommen aufgrund ihrer Variabilität und breiten sich dann aus. Trypanosomen haben 2000 VSG-Gene, die durch Genkonversion zu einer riesigen Vielfalt gemixt werden.
Kapitel 6: Nachwort
Bei Infektionen und Abwehr geht es ums Überleben, da zählt nicht die eleganteste Lösung, sondern alles, was funktioniert. Ständig werden alte Gene ausgeborgt und durch Mutation zurechtgebogen oder durch Exon-Shuffling neu zusammengewürfelt; permanente Umwälzung.