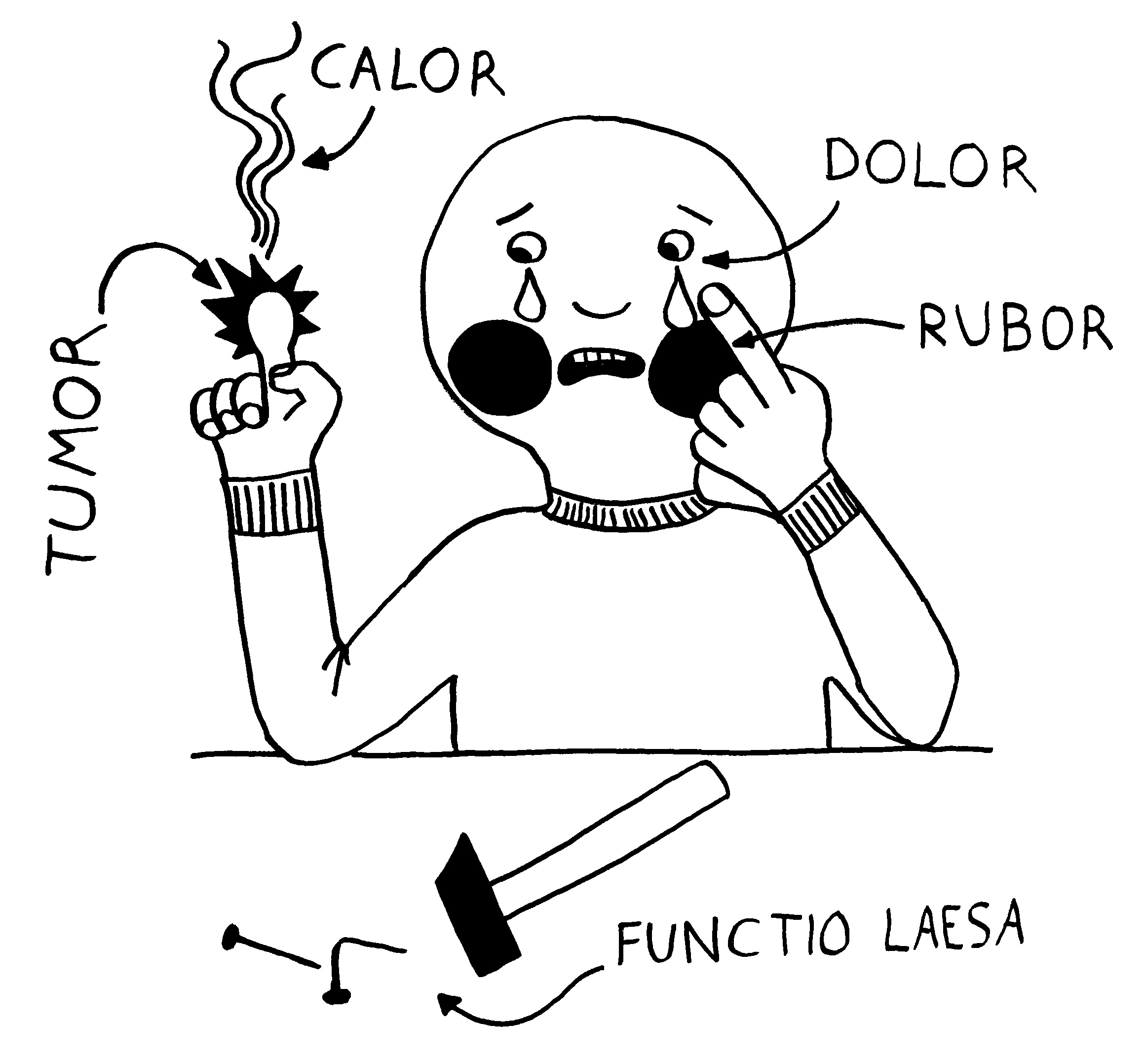
Medizinstudenten lernen im Studium die fünf klassischen Entzündungszeichen auswendig: rubor, tumor, calor, dolor und functio laesa, also Rötung, Schwellung, Erwärmung, Schmerz und Funktionsbeeinträchtigung . Der Schmerz ist eine Folge der örtlichen Reizung der Nerven und führt zu genesungsförderlichen Verhaltensweisen wie der Schonung des betroffenen Körperteils, solange dessen Funktion beeinträchtigt ist. Die Rötung rührt von einer starken Durchblutung her, die den raschen Transport von Immunzellen an ihren Einsatzort gewährleistet. Die Schwellung geht auf eine örtlich erhöhte Durchlässigkeit der Gefäßwände zurück, die den Immunzellen das Eindringen ins Gewebe erleichtert. Ausgelöst wird sie durch die Ausschüttung von Histamin, Serotonin und anderen sogenannten Gefäßmediatoren.
Die an den Entzündungsherd vorgedrungenen Immunzellen übernehmen unterschiedliche Aufgaben: B-Zellen werden zu Plasmazellen und schütten spezifische Antikörper aus, die die Antigene bedecken und so unter anderem die Komplementreaktion auslösen. Granulozyten schütten den Inhalt ihrer Granula aus, bringen so Keime oder beschädigte Zellen zum Absterben, schädigen aber auch das umliegende Gewebe. Phagozyten wie die Makrophagen vertilgen Keime und abgestorbene Zellen, und so weiter. Durch die Granula-Ausschüttung und den Zerfall beschädigter Zellen ist entzündetes Gewebe sauer: Der pH-Wert sinkt von etwa 7,5 in gesundem Gewebe auf etwa 5,5 oder noch stärker ab.
Die Erwärmung zeugt von starker Stoffwechseltätigkeit und wird, wenn sie das ganze System erfasst, als Fieber bezeichnet. Die Übertemperatur ist offenbar nicht nur eine unvermeidliche Nebenwirkung der Entzündungsprozesse, sondern stärkt die Widerstandskraft gegen Infektionen. Biochemische Reaktionen laufen – bis zu einer Obergrenze, an der Enzyme und andere Proteine zerfallen – umso schneller ab, je wärmer es ist. Das gilt auch für die Produktion von Antikörpern und antimikrobiellen Substanzen.
Zu Beginn verstärkt sich eine Entzündungsreaktion selbst. Zum Beispiel schütten Mastzellen, die an antikörperbedeckte Antigene binden, aus ihren Granula Histamin aus, das die Gefäßwände durchlässiger macht, sodass noch mehr B-Zellen, Antikörper und Mastzellen an den Ort des Geschehens kommen. Eine Entzündung ist aber ein Ausnahmezustand. Wird sie chronisch, so schädigt sie das Gewebe und das Gesamtsystem. Das ist beispielsweise bei Autoimmunerkrankungen der Fall. Normalerweise setzt recht bald eine Gegensteuerung ein, zum Beispiel durch den Abtransport der Keime und beschädigten Zellen und durch die beruhigende Wirkung regulatorischer T- und B-Zellen auf andere Lymphozyten. Nach Beseitigung der akuten Gefahr wird das umliegende Gewebe zur Regeneration angeregt, zum Beispiel zur Wundschließung durch verstärkte Zellteilung.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de