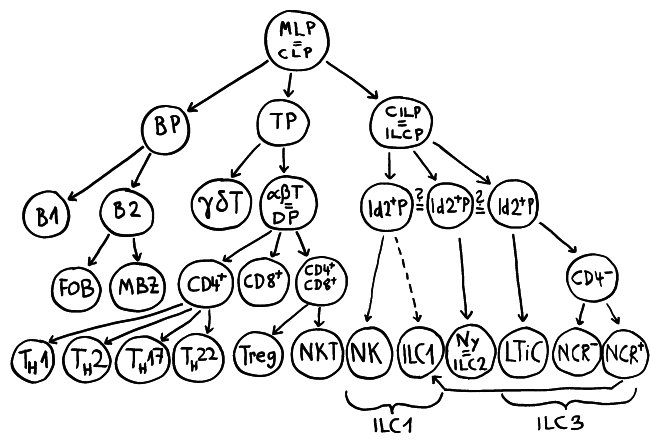
So, puh: der lymphoide Ast des hämatopoetischen Stammbaums, wie er sich nach Lektüre zahlreicher frischer Artikel darstellt. Erläuterungen folgen im Buch – obwohl das alles zum Zeitpunkt der Drucklegung wahrscheinlich schon wieder überholt ist.
Schlagwort-Archiv: B-Zellen
Autoreaktive Plasmazellen als Hausbesetzer
Neue Skizzen fürs Buch:
 Die Zahl der Nischen, in denen reife Plasmazellen (antikörperproduzierende B-Zellen) langfristig überleben können, ist im gesunden Körper begrenzt. Plasmazellen, die keine solche Nische im Knochenmark oder in der Milz ergattern können, sterben ab. So wird das Immunsystem nach einer Infektion wieder auf ein Normalmaß heruntergeregelt.
Die Zahl der Nischen, in denen reife Plasmazellen (antikörperproduzierende B-Zellen) langfristig überleben können, ist im gesunden Körper begrenzt. Plasmazellen, die keine solche Nische im Knochenmark oder in der Milz ergattern können, sterben ab. So wird das Immunsystem nach einer Infektion wieder auf ein Normalmaß heruntergeregelt.
 Bei einer Autoimmunattacke wird der Organismus von zahlreichen Plasmazellen überschwemmt, die autoreaktive Antikörper produzieren. Durch ihre schiere Überzahl können sie einer Hypothese zufolge alte Plasmazellen aus ihren Überlebensnischen verdrängen, so dem Zelltod entkommen und weiterhin Autoantikörper produzieren. Da sie sich in diesem Stadium nicht mehr vermehren, ist ihnen mit den üblichen Immunsuppressiva schwer beizukommen, denn diese Wirkstoffe setzen überwiegend an der Zellteilung an (Zytostastika).
Bei einer Autoimmunattacke wird der Organismus von zahlreichen Plasmazellen überschwemmt, die autoreaktive Antikörper produzieren. Durch ihre schiere Überzahl können sie einer Hypothese zufolge alte Plasmazellen aus ihren Überlebensnischen verdrängen, so dem Zelltod entkommen und weiterhin Autoantikörper produzieren. Da sie sich in diesem Stadium nicht mehr vermehren, ist ihnen mit den üblichen Immunsuppressiva schwer beizukommen, denn diese Wirkstoffe setzen überwiegend an der Zellteilung an (Zytostastika).
Henne oder Ei: Probleme der Abgrenzung zwischen Autoimmunerkrankungen und chronischen Entzündungen
Überblick: Typ-1-Diabetes
Diese Review-Sammlung der Zeitschrift Cold Spring Harbor Perspectives in Medicine umfasst 18 frei zugängliche Artikel aus dem Jahr 2012, von denen ich bisher fünf gelesen habe. Notizen zum Einführungsartikel:
Mark A. Atkinson, Pathogenese und Naturgeschichte von T1D: sehr guter Überblick, auch über ungeklärte Fragen.
Anteil T1D-Fälle, die erst bei Erwachsenen diagnostiziert werden: 35-50%. Etwa 5-15% der Erwachsenen mit T2D-Diagnose dürften tatsächlich T1D haben. 2 Gipfel: erster bei Kindern von 5-7 Jahren, zweiter nahe Pubertät. M und F etwa gleich oft betroffen, leichter Männerüberschuss. T1D-Diagosen im Herbst und Winter häufiger als im Frühjahr/Sommer -> evtl. Umweltfaktor an Symptomausbruch beteiligt. Studie SEARCH: Etwa 0,26% aller unter 20-Jährigen haben Diabetes (T1D oder T2D); bei unter 10-Jährigen 19,7/100.000 neue Fälle/Jahr, bei über 10-Jährigen 18,6/100.000; Ethnien: bei weißen Nicht-Latinos unter 10 Jahren höchste Inzidenz (24,8/100.000).
Bandbreite der Inzidenzen zwischen Ländern, aus denen Daten vorliegen: über 350-fach! I. A. positiv korreliert mit Breitengrad. Selten in Indien, China, Venezuela; sehr häufig in Finnland (> 60/100.000/Jahr) und Sardinien (etwa 40/100.000/Jahr); > 20/100.000/Jahr in Schweden, Norwegen, Portugal, GB, Kanada, Neuseeland. Estland: weniger als 75 Meilen von Finnland entfernt, aber T1D-Rate weniger als 1/3 der finnischen. Puerto Rico: selbe Rate wie Festland-USA, benachbartes Kuba dagegen weniger als 3/100.000/Jahr. Inzidenzen steigen weltweit seit Jahrzehnten, besonders stark bei den unter 5-Jährigen. In Schweden scheint Plateau erreicht zu sein. Anstieg viel zu schnell für Verschiebung der genetischen Empfänglichkeit. Anteil Betroffener mit Risikoallelen (v. a. im MHC-II-Komplex) scheint vielmehr gesunken zu sein. Weiterlesen
Was passiert bei Immunneuropathien?
Ich habe meine Fazialislähmung zum Anlass genommen, für das Buch zu skizzieren, wie eine Immunneuropathie abläuft. Zu den Immunneuropathien zählen Autoimmunerkrankungen wie Multiple Sklerose, das Guillain-Barré-Syndrom, chronisch inflammatorische demyelinisierende Polyneuropathie (CIDP) oder vaskulitische Neuropathie. Bei einigen ist das periphere, bei anderen das zentrale Nervensystem betroffen. Oft beschränkt sich die Störung (wie bei der Fazialislähmung) auf einen einzelnen Nerv.
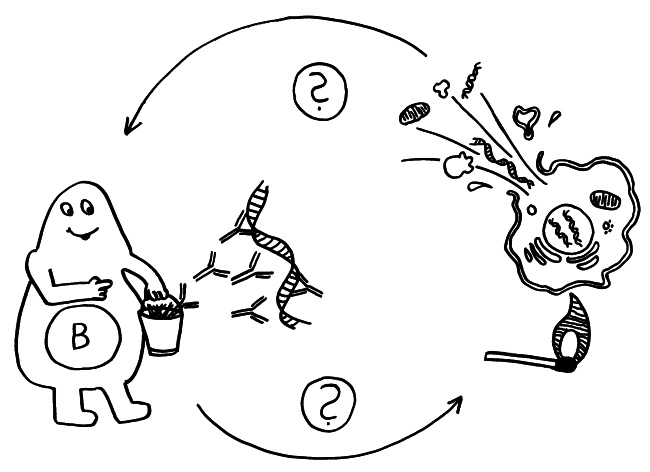
Am Anfang steht vermutlich immer die Reaktivierung eines latenten Virus (z. B. Herpes) oder eine oftmals unbemerkte, da symptomfreie (sogenannte stumme oder maskierte) Infektion, hier durch ein maskiertes Bakterium dargestellt. Eine in der Blutbahn oder im Gewebe patrouillierende Immunzelle – hier eine dendritische Zelle (DC) – entdeckt den Eindringling:
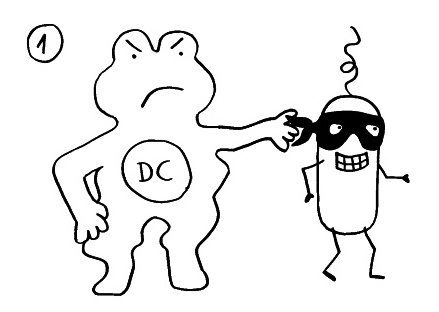 Die dendritische Zelle nimmt Teile des Erregers auf und verarbeitet sie zu einem präsentablen Antigen weiter. Sie verwandelt sich in eine antigenpräsentierende Zelle (APC), die einer T-Helferzelle das Antigen auf ihrem MHC-Klasse-II-Rezeptor (hier: Tablett) präsentiert. Damit es nicht zu Fehlalarmen kommt, gibt es einen Sicherheitsmechanismus: T-Helferzellen reagieren nur dann auf ein Antigen, wenn ihnen gleichzeitig auf einem anderen Rezeptor ein sogenanntes kostimulierendes Signal präsentiert wird, das anzeigt, dass wirklich eine Infektion oder eine andere Gefahr vorliegt, die bekämpft werden muss (hier: Kerze). Auf der Oberfläche der T-Zelle gibt es für beide Signale spezifische Rezeptoren (hier: Augen/Blickkontakt):
Die dendritische Zelle nimmt Teile des Erregers auf und verarbeitet sie zu einem präsentablen Antigen weiter. Sie verwandelt sich in eine antigenpräsentierende Zelle (APC), die einer T-Helferzelle das Antigen auf ihrem MHC-Klasse-II-Rezeptor (hier: Tablett) präsentiert. Damit es nicht zu Fehlalarmen kommt, gibt es einen Sicherheitsmechanismus: T-Helferzellen reagieren nur dann auf ein Antigen, wenn ihnen gleichzeitig auf einem anderen Rezeptor ein sogenanntes kostimulierendes Signal präsentiert wird, das anzeigt, dass wirklich eine Infektion oder eine andere Gefahr vorliegt, die bekämpft werden muss (hier: Kerze). Auf der Oberfläche der T-Zelle gibt es für beide Signale spezifische Rezeptoren (hier: Augen/Blickkontakt):
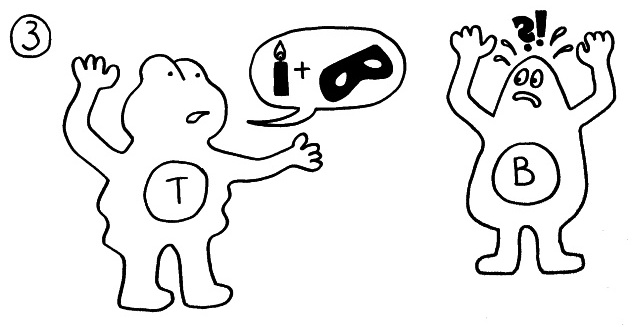
 Die T-Helferzellen reichen die Information über das Vorliegen eines Gefahr (Kerze) und über die genaue Art der Gefahrenquelle, also das Antigen (Augenbinde des Bakteriums), über Rezeptoren und Signalstoffe (Sprechblase) an B-Zellen weiter und regen diese so zur Produktion spezifischer Antikörper an:
Die T-Helferzellen reichen die Information über das Vorliegen eines Gefahr (Kerze) und über die genaue Art der Gefahrenquelle, also das Antigen (Augenbinde des Bakteriums), über Rezeptoren und Signalstoffe (Sprechblase) an B-Zellen weiter und regen diese so zur Produktion spezifischer Antikörper an:
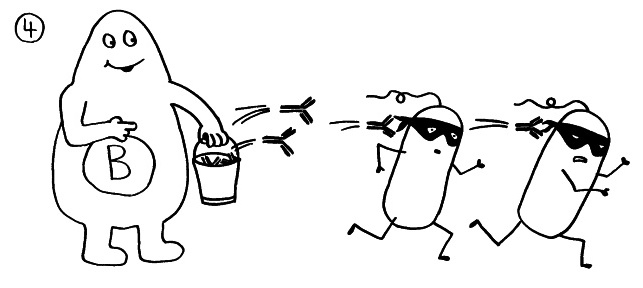
 Die B-Zellen schütten massenhaft Antikörper aus (Eimer), die spezifisch an „ihr“ Antigen binden und die Gefahrenquellen so zum Teil direkt schachmatt setzen, zum Teil zur anschließenden Zerstörung und Entsorgung markieren:
Die B-Zellen schütten massenhaft Antikörper aus (Eimer), die spezifisch an „ihr“ Antigen binden und die Gefahrenquellen so zum Teil direkt schachmatt setzen, zum Teil zur anschließenden Zerstörung und Entsorgung markieren:
 Diese normale Immunreaktion spielt sich in der Blutbahn, im Lymphgewebe und lokal im infizierten Gewebe ab. Aber manchmal läuft etwas schief: Aktivierte T-Zellen können die Blut-Nerven-Schranke durchdringen und von der Blutbahn (im nächsten Bild links) in einen Nerv (rechts) überwechseln. Das sollte eigentlich nicht passieren, da Nerven zu den sogenannten immunprivilegierten Orten im Körper gehören: Da Entzündungsreaktionen hier viel Schaden anrichten können, sind diese Orte für die meisten Immunzellen tabu. Weiterlesen
Diese normale Immunreaktion spielt sich in der Blutbahn, im Lymphgewebe und lokal im infizierten Gewebe ab. Aber manchmal läuft etwas schief: Aktivierte T-Zellen können die Blut-Nerven-Schranke durchdringen und von der Blutbahn (im nächsten Bild links) in einen Nerv (rechts) überwechseln. Das sollte eigentlich nicht passieren, da Nerven zu den sogenannten immunprivilegierten Orten im Körper gehören: Da Entzündungsreaktionen hier viel Schaden anrichten können, sind diese Orte für die meisten Immunzellen tabu. Weiterlesen
Veränderungen peripherer mononukleärer Blutzellen: Indizien für Autoimmunstörung bei idiopathischer peripherer Fazialislähmung
Stefan S. Kassner et al.: Changes in Peripheral Blood Mononuclear Cells – Novel Evidence for an Immunomodulatory Aspect in Bell’s Palsy? Journal of Neurology Research, Vol. 2, No. 3, Jun 2012; doi:10.4021/jnr108w
Abstract: Früheren Studien zufolge ist bei Patienten mit Bell’s palsy (BP) die Zahl der T- und B-Lymphozyten signifikant verringert. Als mögliche Ursachen der Erkrankung gelten Vireninfektionen und Autoimmunprozesse. In dieser Studie wurden die peripheren mononukleären Blutzellen (PBMCs) von 15 BP-Patienten anhand ihrer Oberflächenmarker (CD) genauer charakterisiert: Bei den Monozyten (= Makrophagenvorläuferzellen, CD14+), Makrophagen (CD68+), T-Lymphozyten (CD3+) und B-Lymphozyten (CD19+) wurde der Anteil der Zellen sowie die Expression entzündungsfördernder (CD40+, TNF-α und COX-2), apoptosefördernder (Caspase-3, PARP), adhäsionsfördernder (CD38+) und mit oxidativem Stress verbundener (MnSOD) Proteine gemessen. Die Ergebnisse deuten auf eine Beteiligung des Immunsystems an Bell’s palsy hin.
Einleitung: Der Mangel an antikörperproduzierenden CD19+-B-Zellen bei BP-Patienten wird in der Literatur als mögliche Unrsache für den Krankheitsausbruch oder -fortgang diskutiert, weil dadurch womöglich neurotrope Viren (ihre DNA und/oder ihre Hüllen) nicht mehr effizient aus den infizierten Nerven entfernt werden können. HSV-1-DNA (Herpes simplex) wurde in der Nervenflüssigkeit und im Speichel von BP-Patienten nachgewiesen. Im Tiermodell ließ sich BP durch HSV-1-Reaktivierung im Verbund mit Immunsuppression auslösen. Weiterlesen
Gekurve
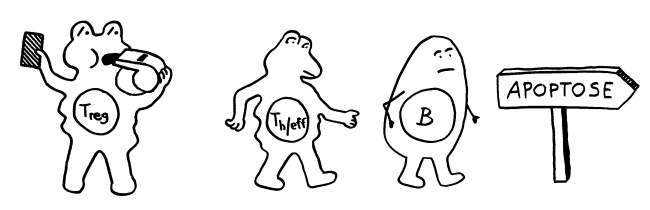
Regulatorische T-Zellen induzieren Apoptose von T- und B-Zellen
Immunologische Meldungen im VBIO-Newsletter 27/2012
Links und Anreißer, aus dem Newsletter des Biologenverbands übernommen:
Natürliche Darmflora kurbelt Immunsystem an
Freiburger Forscher beschreiben in dem Fachmagazin Immunity den Einfluss der natürlichen Darmflora auf die Immunantwort gegen virale Erreger.
Wenn Komponenten der Immunabwehr gesunde Nervenzellen töten
Charité-Studie: Das Absterben gesunder Nervenzellen kann auf Komponenten des Immunsystems zurückgeführt werden.
Kreisverkehr im Lymphknoten
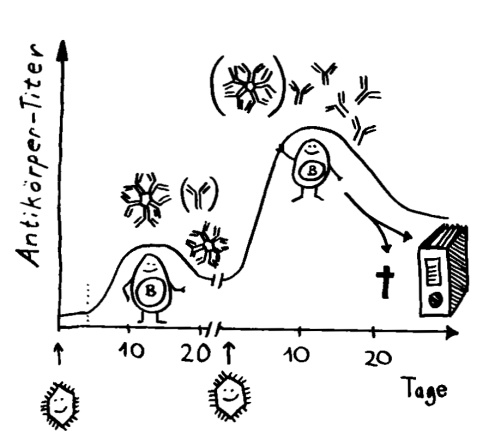
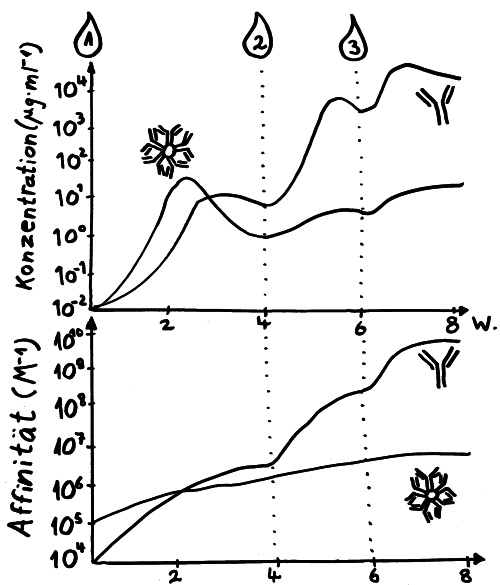
Die asymmetrische Teilung der Antikörper-produzierenden B-Zellen beschleunigt die Immunabwehr. Eine Tochterzelle beginnt schon mit der Produktion von Antikörpern, während die andere versucht, ihre Antikörper weiter zu verbessern.
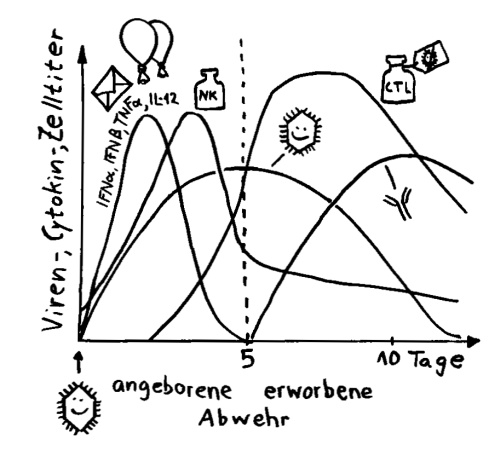
Th1 vs. Th2: zelluläre und humorale Immunantwort
 Die adaptive oder erworbene Immunabwehr besteht im Wesentlichen aus zwei Armen, der zellulären (links) und der humoralen (rechts) Immunantwort. Weiterlesen
Die adaptive oder erworbene Immunabwehr besteht im Wesentlichen aus zwei Armen, der zellulären (links) und der humoralen (rechts) Immunantwort. Weiterlesen