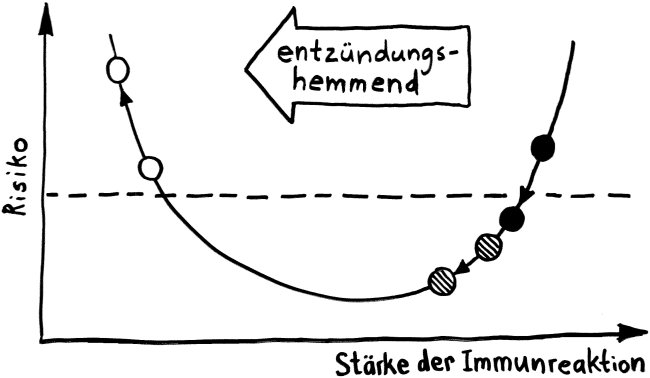
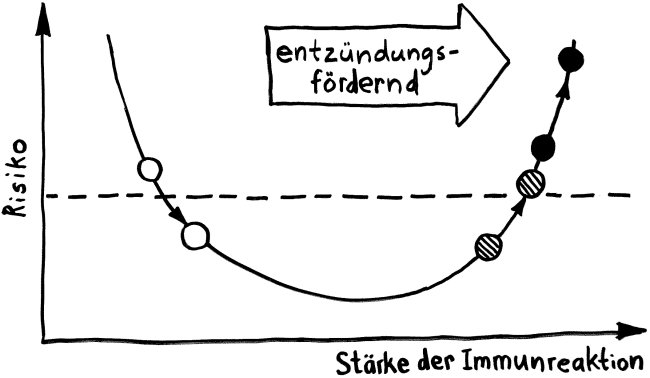
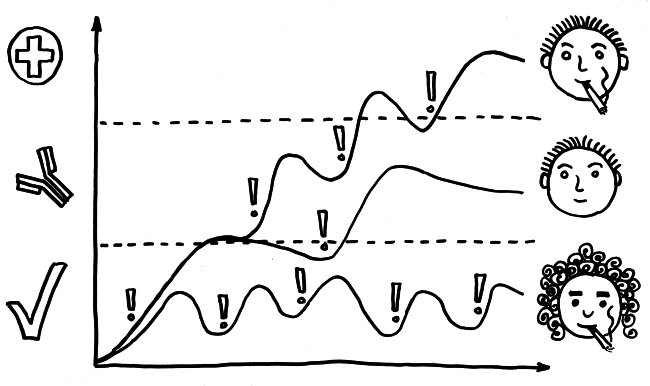
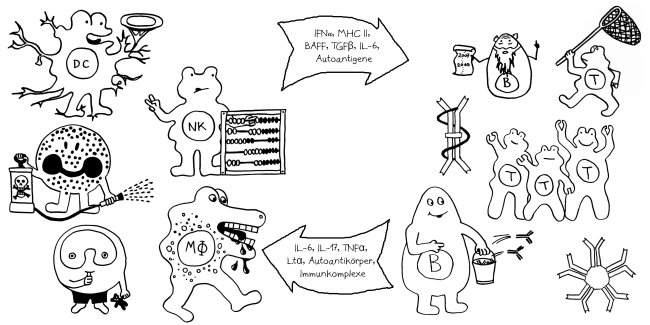
So zumindest der plakative Teaser einer Meldung, die vor gut einem Jahr bei „Science Daily“ erschien. Ein Forscherteam um J. B. Swann an der Uni Freiburg hatte transgene Mäuse hergestellt, in deren Zellen das Gen Foxn1, das einen Regulator der Thymusentwicklung codiert, durch das verwandte, aber evolutionär ältere Wirbeltier-Gen Foxn4 ersetzt ist. Während ein normaler Mäuse-Thymus nur wenige B-Zellen enthält, entsteht bei einer Produktion des Regulators FOXN4 ein Lymphorgan, das sowohl T- als auch B-Zellen heranreifen lässt und an den daher als „bipotent“ bezeichneten Thymus-Vorläufer bei Fischen erinnert. Die Arbeit ist frei verfügbar:
Jeremy B. Swann et al.: Conversion of the Thymus into a Bipotent Lymphoid Organ by Replacement of Foxn1 with Its Paralog, Foxn4. Cell Reports, 2014; DOI: 10.1016/j.celrep.2014.07.017 (PDF)
Der Transkriptionsfaktor FOXN1 ist in Säugetieren unabdingbar für die Differenzierung von TEC-Vorläuferzellen in reife TECs. Er ist vermutlich in einem Wirbeltier-Urahn durch Duplikation des älteren Gens Foxn4 entstanden und hat eine sehr ähnliche, aber im Detail andere DNA-Bindungs-Domäne.
Die Vorfahren der Wirbeltiere waren sogenannte Schädellose. Von diesem Unterstamm der Chordatiere leben nur noch die Lanzettfischchen. Im Embryo des Lanzettfischchens Branchiostoma floridae, das kein Foxn1-Gen hat, wird im Rachen-Endoderm Foxn4 exprimiert. Das brachte die Forscher auf den Gedanken, dass in dieser Region des Embryos, aus der bei Wirbeltieren ja die Thymusanlage entsteht, vor der Entstehung von Foxn1 der ältere Transkriptionsfaktor FOXN4 für die Ausbildung eines Thymus-ähnlichen Lymphorgans gesorgt hat. In den TECs im Thymus stammesgeschichtlich „mittelalter“ Wirbeltiere wie der Katzenhaie, Zebrafische und Reisfische werden sowohl Foxn1 als auch Foxn4 exprimiert, in Säugetier-TECs normalerweise nur noch Foxn1.
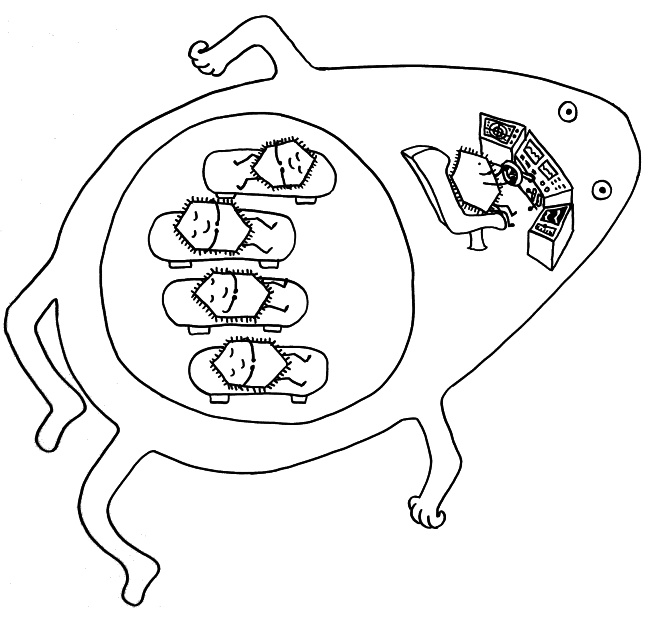
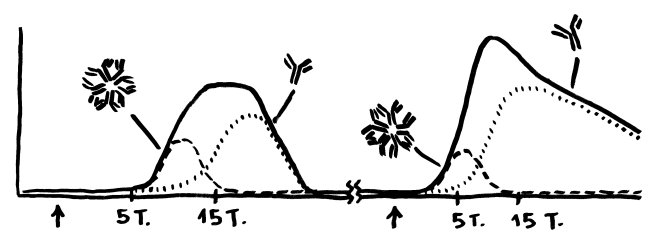
Wenn man aber in transgenen Mäusen die Foxn1-Expression ausschaltet und zugleich die FOXN4-Produktion erhöht, kann dieses Protein FOXN1 bei der Thymusentwicklung zumindest teilweise ersetzen. Es entstehen normal funktionierende cTECs und mTECs. Allerdings ist ihre Keratin-Expression abnorm: Die meisten TECs exprimieren nun sowohl den Cortex-Marker Keratin 8 als auch das Mark-typische Keratin 5. Außerdem kommen im Thymus der FOXN4-produzierenden Mäuse zahlreiche unreife B-Zellen vor, die sich dort auch teilen. Sie halten sich vor allem rings um die Blutgefäße auf, die den Thymus durchziehen – vermutlich, weil die Fibroblasten dort FLT3-Ligand exprimieren, ein Schlüsselelement der B-Zell-Entwicklung, die sich normalerweise im Knochenmark abspielt. Das FOXN4-produzierende Thymus-Epithel ist also nicht nur zur T-Zell-Entwicklung imstande, sondern bietet auch B-Zellen ein entwicklungsfreundliches Umfeld. Bei Fischen, die von Natur aus sowohl Foxn1 als auch Foxn4 exprimieren, ist die Anwesenheit von B-Zellen im Thymus dann auch normal. Unklar bleibt, ob die im Thymus der transgenen Mäuse entstehenden B-Zellen und T-Zellen vom selben Vorläufer-Zelltyp abstammen, der sich erst im Thymus für einen Entwicklungsweg entscheidet, oder von zwei unterschiedlichen Vorläufern, die bereits „vorbestimmt“ aus dem Knochenmark in den Thymus einwandern.
Die T-Zell-Reifung im Säugetier-Thymus hängt von vier FOXN1-abhängigen Faktoren ab: CCL25, CXCL12, KITL und DLL4. DLL4 steht dabei an der Spitze der Hierarchie. Die B-Zell-Entwicklung im Thymus der genetisch veränderten, Foxn4 exprimierenden Mäuse ist zusätzlich vom allgemeinen Lymphopoese-Faktor IL-7 abhängig. Das Verhältnis von DLL4 zu IL-7 entscheidet darüber, ob der Thymus viele oder wenige unreife B-Zellen hervorbringt. DLL4 ist membrangebunden, das Zytokin IL-7 diffundiert.
Evolution: Man vermutet heute, dass es separate B- und T-Zell-ähnliche Zelltypen bereits in den Urahnen aller Wirbeltiere gab und die immense, durch somatische Rekombination entstehende B- und T-Zell-Rezeptorvielfalt erst später hinzukam. Die ersten Thymus-ähnlichen Lymphorgane entstanden wohl mit Hilfe des Transkriptionsfaktors FOXN4. Nach dessen Duplikation wurden FOXN4 und FOXN1 wohl gemeinsam exprimiert. Auf dem Weg zu den Säugetieren übernahm dann FOXN1 allein die Aufgabe; das Expressionsniveau von Dll4 in den TECs stieg an, und der Thymus war fortan nicht mehr bipotent, sondern nur noch für die T-Zell-Reifung zuständig.