Die erste neue Buchskizze seit einer halben Ewigkeit: Ich schreibe gerade das Kapitel über die immunologisch privilegierten Orte. Das sind Organe und Gewebe in unserem Körper, die teilweise vom Immunsystem isoliert sind, sodass zum Beispiel Implantate in ihnen nicht abgestoßen werden. Solche Immunprivilegien dienen wohl dazu, Organe funktionsfähig zu halten, in denen eine Abwehrreaktion größeren Schaden anrichten würde als ihr Auslöser.
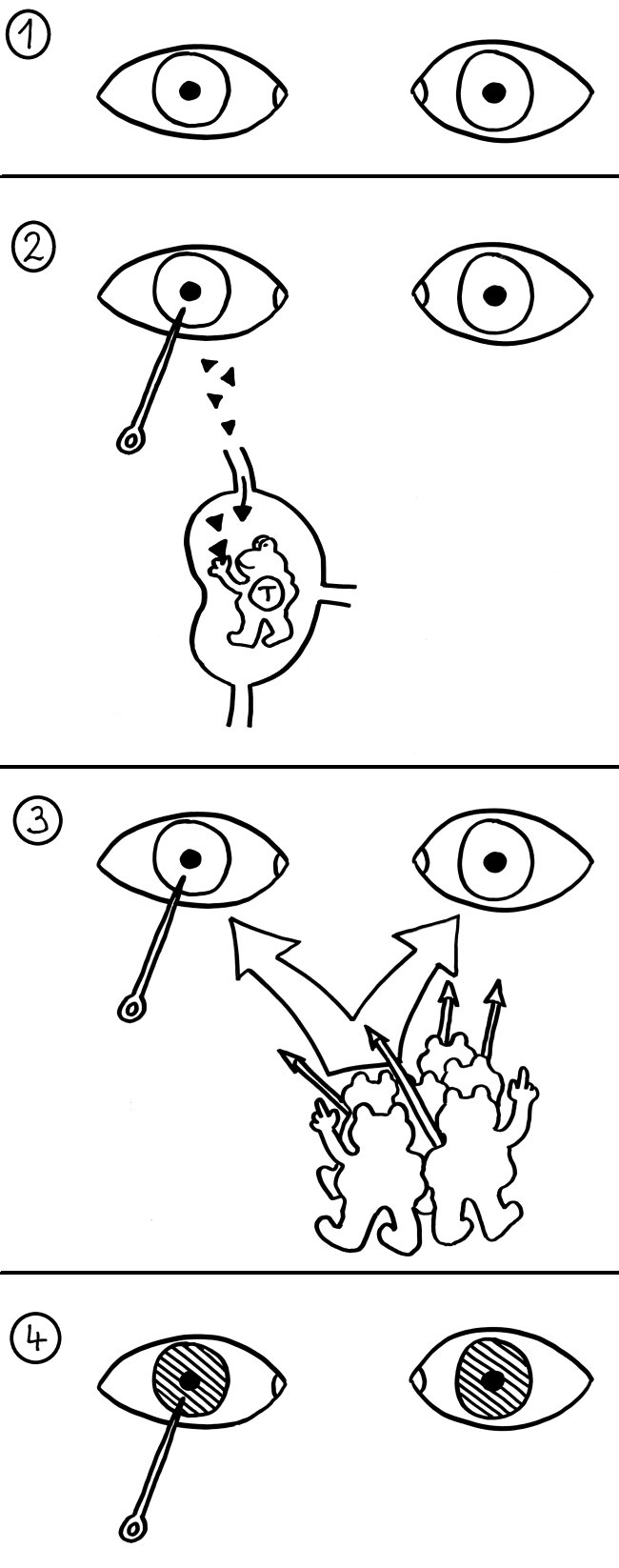
Die vordere Augenkammer (zwischen Hornhaut und Iris gelegen) würde sich zum Beispiel bei einer Entzündung eintrüben. Daher ist die Aktivierungsschwelle für Immunreaktionen in ihr besonders hoch. Im Normalfall gelangen Antigene aus der vorderen Augenkammer – auch Autoantigene – nicht ins Lymphsystem, sodass sie keine zu ihnen passenden T-Zellen aktivieren. Daher suchen T-Zellen diesen Ort auch nicht gezielt auf. Wie gesagt: im Normalfall. Dieses „Privileg“ ist allerdings teuer erkauft: Wenn durch eine Verletzung doch einmal Augen-Antigene in den Körper gelangen, kann das zur vollständigen Erblindung führen – durch eine Autoimmunerkrankung mit dem Namen sympathische Ophthalmie. („Sympathisch“ heißt nämlich ursprünglich „gleichzeitig betroffen“.)
1. Im Normalfall sind unsere vorderen Augenkammern vom Rest des Körpers isoliert: Die Hornhaut enthält keine Blutgefäße, die umliegenden Blutgefäße sind durch tight junctions gründlich abgedichtet und es gibt keine Lymphgefäße in unmittelbarer Nähe.
2. Wird ein Auge verletzt, können aber doch Autoantigene aus dem Inneren ins Lymphsystem und dann in den nächstgelegenen Lymphknoten gelangen. Dort treffen sie u. U. auf T-Zellen, deren Rezeptoren genau diese Antigene erkennen – und die im Rahmen der zentralen oder peripheren Toleranz-Induzierung nicht ausgeschaltet wurden, da sie „ihren“ Antigenen ja normalerweise nie begegnen. Diese T-Zellen werden nun aktiviert und vermehren sich.
3. Die aktivierten T-Zellen folgen chemischen Signalen, um zu ihrem Einsatzort zu finden – also dem Ort, an dem die Antigene vorkommen, die sie bekämpfen wollen. Sie können ja nicht wissen, dass es sich nicht um Fremdstoffe handelt, sondern um normale Inhaltsstoffe des Auges. Und sie unterscheiden auch nicht zwischen den Augen, die für sie beide nach „Ziel“ riechen.
4. Die T-Zellen dringen in beide vordere Augenkammern ein und lösen eine heftige Abwehrreaktion gegen die dortigen Autoantigene aus. Dabei trüben sich die Augen so sehr ein, dass der Betroffene einige Wochen oder Monate nach der Verletzung beidseitig erblinden kann. Heilung ist – wie bei fast allen Autoimmunerkrankungen – nicht möglich. Wenn man die Gefahr rechtzeitig erkennt, kann man aber durch Entfernen des verletzten Auges wenigstens das andere Auge retten.