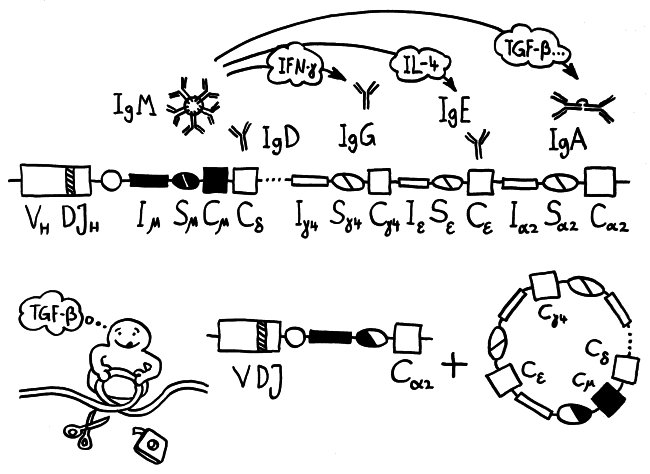
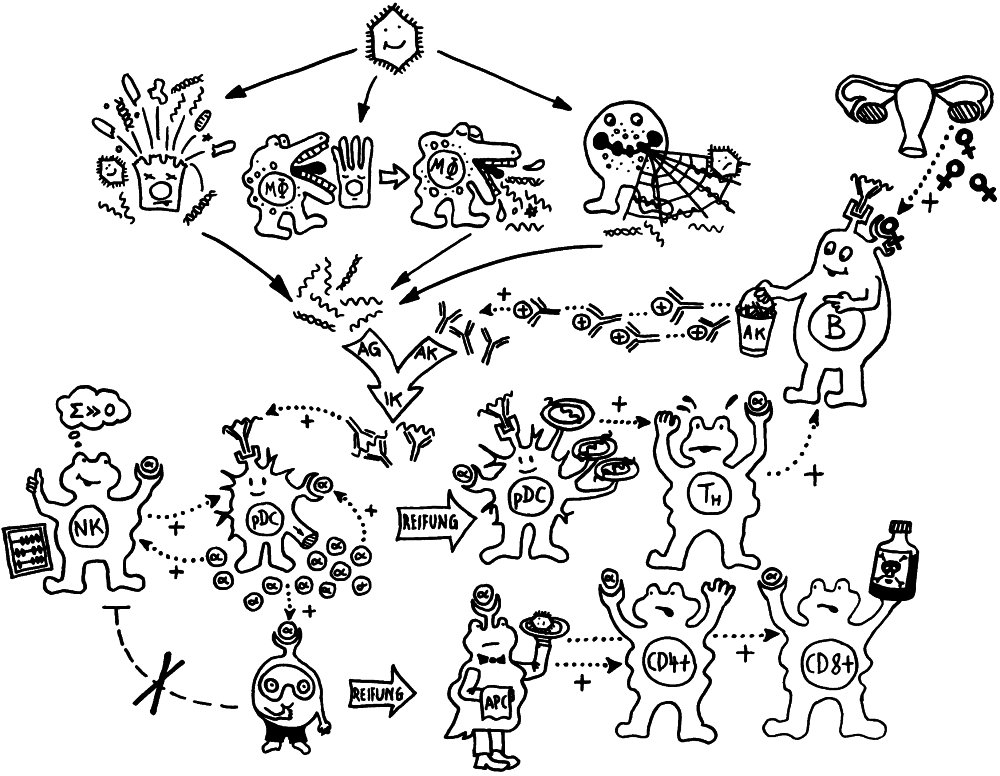
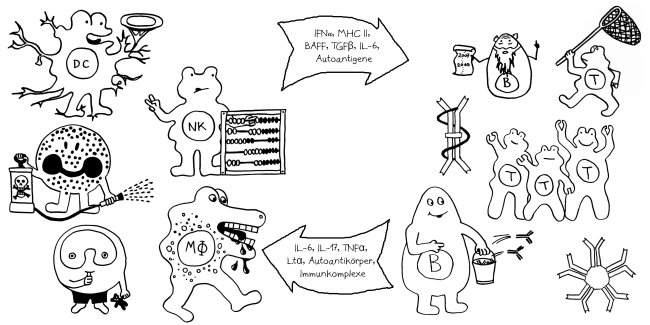
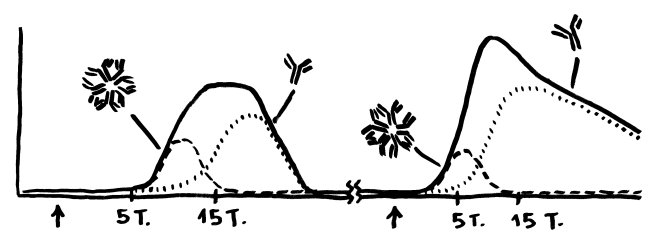
Letzte Zeichnung vor dem Wiedereinstieg in die Büroarbeit nach dem Jahreswechsel: der Klassenwechsel bei den Immunglobulinen. Erläuterungen folgen im Buch.
Archiv der Kategorie: Neues vom Buch
Epstein-Barr-Viren kapern und überdauern in B-Zellen
Etliche Bakterien und Viren entziehen sich der Abwehr, indem sie sich ausgerechnet im Inneren von Immunzellen einnisten. Eines der bekanntesten Beispiele ist das Humane Immundefizienz-Virus (HIV), das in T-Zellen überdauert. Viel häufiger und zum Glück weniger gefährlich ist das Epstein-Barr-Virus (EBV), das zu den Herpes-Viren gehört und sich in unseren B-Zellen versteckt. Einmal infiziert, trägt man es so ein Leben lang mit sich herum, und meistens bemerkt man davon nichts.
Bis zum 35. Lebensjahr haben sich über 95 Prozent aller Menschen das Virus zugezogen. Während sich in den Entwicklungsländern – wie früher auch bei uns – die meisten bereits als Kleinkinder symptomfrei anstecken, infizieren sich etliche Menschen in hoch entwickelten Ländern mit guter Hygiene erst als Jugendliche oder junge Erwachsene und entwickeln dann das Pfeiffer-Drüsenfieber. Nach einer akuten Infektionsphase in den Mandeln startet das Virus ein Latenzprogramm: Es nistet sich in langlebigen B-Gedächtniszellen ein, in denen es nicht weiter stört, aber die Funktion der B-Zellen subtil beeinflussen kann. Die B-Gedächtniszellen wandern über die Blutbahn in andere Organe.
Schon lange steht das Virus im Verdacht, bei Menschen mit entsprechender genetischer Veranlagung den Ausbruch von Autoimmunerkrankungen zu fördern, etwa Lupus, Multiple Sklerose, rheumatoide Arthritis, Hashimoto-Thyreoiditis, Sjögren-Syndrom, Typ-1-Diabetes, systemische Sklerose oder chronisch-entzündliche Darmerkrankungen. Gegen welches Organ oder Gewebe sich die Autoimmunreaktionen richten, scheint von ererbten Risikoallelen abzuhängen, insbesondere von bestimmten MHC-Klasse-II-Genvarianten und einer Veranlagung zu einem Mangel an regulatorischen T-Zellen (Tregs). Aber wie tragen die Viren zum Ausbruch der Autoimmunerkrankung bei? Alle möglichen Mechanismen werden in der Literatur diskutiert: molekulare Mimikry zwischen EBV-Proteinen wie EBNA-1 und menschlichen Proteinen wie dem Lupus-Autoantigen Ro, Bystander Activation autoreaktiver T-Zellen durch Entzündungssignale aus den infizierten B-Zellen, Epitope Spreading über das anfangs dominante EBV-Antigen hinaus oder polyklonale Antikörperbildung im Zuge der Vermehrung und Aktivierung der befallenen B-Zellen.
Außerdem wurde spekuliert, die Viren könnten naive autoreaktive B-Zellen so umprogrammieren, dass sie sich auch ohne Aktivierung durch Autoantigen-Kontakt in sehr langlebige Gedächtnis-B-Zellen umwandeln, die dann später Autoimmunreaktionen auslösen. Die Viren könnten auch endogene Retroviren wie HERV-K18 oder HERV-W aktivieren, die normalerweise untätig in unserem Genom schlummern, nach ihrer Erweckung durch EBV aber Superantigene herstellen, die zahlreiche T-Zellen polyklonal aktivieren könnten. Bewiesen ist aber nichts.
Dass im Blut von Patienten mit Autoimmunerkrankungen manchmal deutlich mehr Anti-EBV-Antikörper oder EBV-DNA-Moleküle nachzuweisen sind als bei Gesunden, belegt noch keine Verursachung der Erkrankung durch EBV: Vielleicht stört umgekehrt die Autoimmunerkrankung das Gleichgewicht in den infizierten B-Zellen, sodass die Viren aus ihrem Latenzzustand erwachen und sich vermehren. Da die üblichen Tiermodelle für Autoimmunerkrankungen, insbesondere Mäuse- und Rattenstämme, sich nicht mit EBV infizieren lassen, können auch Tierversuche keine rasche Klärung bringen.
Bystander Activation und Epitope Spreading
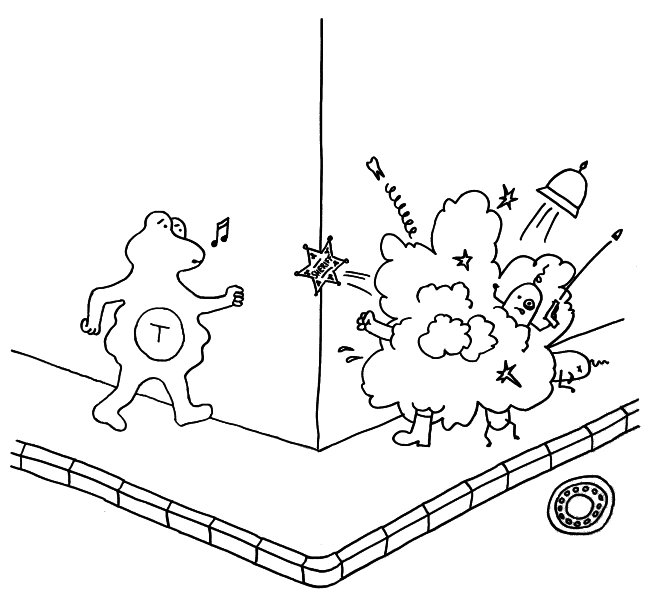
Bystander activation (Aktivierung Unbeteiligter) und epitope spreading (Epitop-Ausweitung) sind zwei der vier meistdiskutierten Mechanismen, über die sich akute Infektionen zu chronischen Autimmunerkrankungen auswachsen können.
Bei einer bystander activation liefert die Bekämpfung einer akuten Infektion (rechts) Signale, die zufällig in der Nähe befindliche autoreaktive T-Zellen (links) aktivieren – etwa Interferon-α bei einer Vireninfektion oder Kostimulationssignale auf antigenpräsentierenden Zellen.
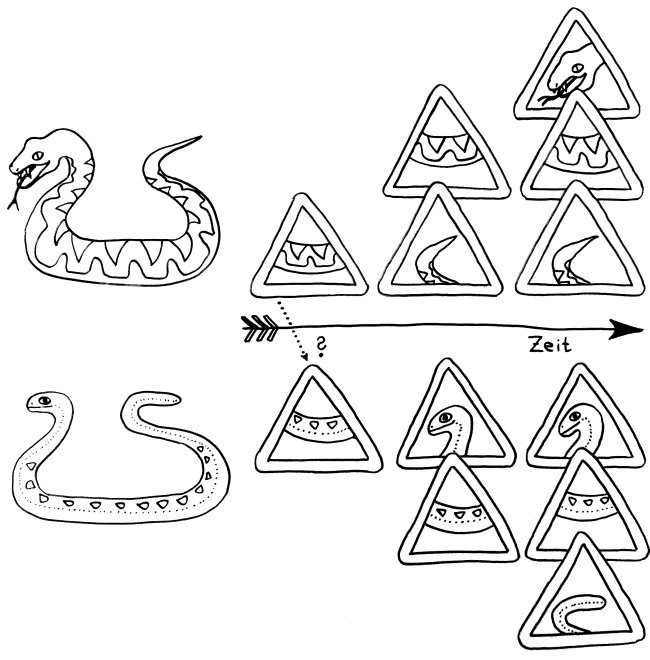
Epitope spreading sorgt dafür, dass die Abwehr, die zunächst nur ein Epitop (einen kurzen Abschnitt) eines Antigens erkennt, nach und nach auch andere Epitope dieses Antigens und evtl. auch anderer, mit ihm gemeinsam auftretender Antigene erkennt. Im Fall eines tatsächlich gefährlichen Antigens (Schlange) macht das die Abwehr schlagkräftiger. Aber wenn das System fälschlicherweise auf ein harmloses Autoantigen (Blindschleiche) anspringt, kann derselbe Mechanismus auch die Autoimmunreaktion ausweiten.
Die anderen beiden Hauptmechanismen sind die molekulare Mimikry (siehe z. B. Punkt 5 im Artikel über Immunneuropathien) und die Aktivierung von T-Zellen durch Superantigene (siehe z. B. unterste Abbildung im Artikel über MHC-Moleküle und Superantigene). Die vier Mechanismen schließen einander nicht aus, sondern ergänzen sich. So kann das ursprüngliche „Missverständnis“ beim epitope spreading (gepunkteter Pfeil) durch molekulare Mimikry zustande kommen.
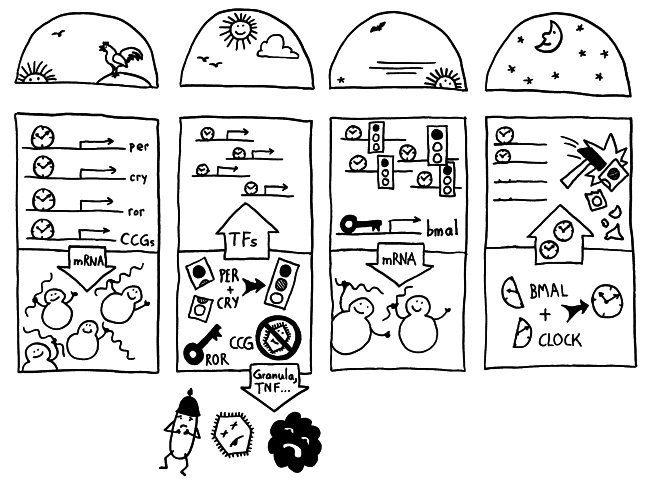
Die NK-Zell-Uhr
Neben der zentralen biologischen Uhr im Hypothalamus (siehe voriger Beitrag) schwingen auch im restlichen Körper viele Vorgänge im 24-Stunden-Takt. Dank dieser lokalen Uhren, die regelmäßig durch Impulse aus dem SCN synchronisiert werden, können sich die Zellen auf regelmäßig wiederkehrende Situationen einstellen. Natürliche Killerzellen (NK-Zellen) dienen z. B. der Bekämpfung von Pathogenen, die zumeist tagsüber während unserer aktiven Phase in den Körper eindringen.
Die Halbkreise geben die Tageszeit (morgens, mittags, abends, nachts) an. Die obere Hälfte der vier Rechtecke stellt jeweils den Zellkern dar, die untere Hälfte das Zytoplasma, also den Zellbereich außerhalb des Kerns. Die Vorgänge sind extrem vereinfacht dargestellt; tatsächlich gibt es z. B. noch mehr Uhrgene, die der Stabilisierung des Rhythmus dienen.
Morgens werden die Uhrgene per, cry und ror abgelesen: Das Protein BMAL/CLOCK (die Uhr) hat an Sequenzen in deren Promotorbereichen angedockt und fördert so ihre Transkription. Außerdem fördert es die Ablesung zahlreicher anderer Gene, der sogenannten clock-controlled genes oder CCGs – in NK-Zellen zum Beispiel Gene, die für die Pathogenbekämpfung nötig sind. Die Transkriptionsprodukte (sogenannte Messenger-RNA oder mRNA) wandern aus dem Zellkern ins Zytoplasma und werden dort von den Ribosomen in Empfang genommen – den Proteinfabriken, die anhand der Bauanleitung in der mRNA Aminosäuren zu neuen Proteinen zusammensetzen.
Mittags haben die NK-Zellen große Mengen der Proteine hergestellt. Einen Teil davon scheiden die Zellen aus, um Viren, Bakterien und Krebszellen auszuschalten – zum Beispiel Giftstoffe aus ihren Granula (Membranbläschen) oder Botenstoffe wie den Tumornekrosefaktor (TNF). Die Proteine PER und CRY lagern sich dagegen zusammen, werden aktiviert und wandern – genau wie das Protein ROR – in den Zellkern ein. Diese Proteine sind Transkriptionsfaktoren; sie beeinflussen also die Ablesung von Genen – genau wie BMAL/CLOCK.
Abends werden die morgens fleißig transkribierten Gene nicht mehr abgelesen, da das Protein PER/CRY (Ampel) die Aktivierung durch BMAL/CLOCK (Uhr) unterbindet. Der Transkriptionsfaktor ROR hat dagegen an eine Sequenz im Promotor des Gens bmal gebunden und so dessen Ablesung eingeschaltet. Er zieht gewissermaßen die Zelluhr auf; daher der Schlüssel. Die bmal-mRNA wandert ins Zytoplasma und wird dort von Ribosomen in Empfang genommen.
Nachts haben die NK-Zellen so viel BMAL hergestellt, dass es sich mit seinem Gegenpart CLOCK zusammenlagern kann. Das Protein tritt in den Zellkern über und ersetzt dort alte, nicht mehr funktionstüchtige BMAL/CLOCK-Einheiten. PER/CRY hat ausgedient und wird von Enzymkomplexen, sogenannten Proteasomen, abgebaut (Hammer).
Damit schließt sich der Kreis. So werden die gefährlichen Wirkstoffe, deren Herstellung zudem viel Energie verbraucht, jeden Tag „just in time“ produziert: dann, wenn Pathogene in unseren Körper eindringen.
(Abbildung inspiriert durch Logan RW & Sarkar DK, „Circadian nature of immune function“, Molecular and Cellular Endocrinology 349 (2012) 82-90, und Gibbs JE & Ray DW, „The role of the corcadian clock in rheumatoid arthritis“, Arthritis Research & Therapy 2013, 15:205)
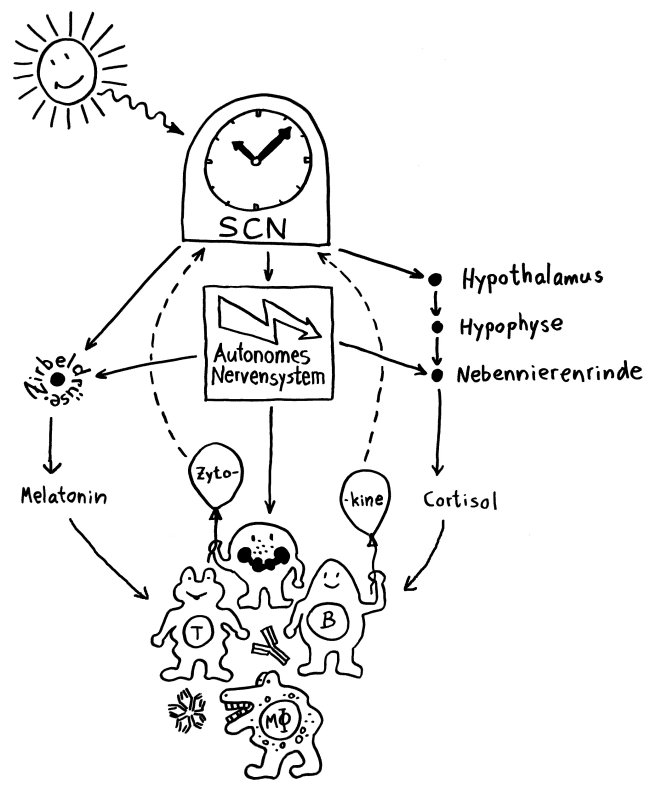
Wie erfährt Immunsystem, wie spät es ist?
Auf drei Wegen: über das Hormon Melatonin aus der Zirbeldrüse, über das Hormon Cortisol aus der Hypothalamus-Hypophysen-Nebennierenrinden-Achse und über das autonome Nervensystem, das Signale an die endokrinen Drüsen und an Lymphorgane wie Milz und Leber übermittelt:
Alle drei Instanzen beziehen die zentrale Uhrzeit vom suprachiasmatischen Nucleus (SCN), einem Teil des Hypothalamus. Der circadiane Rhythmus im SCN wird regelmäßig durch Tageslicht nachjustiert, damit die zentrale Uhr nicht vor- oder nachgeht.
Auch das Immunsystem kann die zentrale Uhr verstellen, zum Beispiel, wenn der Körper bei einer Infektion Ruhe braucht. Dann senden die Immunzellen Zytokine aus, Botenstoffe, die im SCN die Ablesung der Uhr-Gene beeinflussen.
(Abbildungsvorlage aus Mavroudis PD et al., Systems biology of circadian-immune interactions. J Innate Immun 2013; 5:153-162)
Schichtarbeit: Der Tag-Nacht-Rhythmus von Immunreaktionen
Neulich las ich, dass selbst schwaches Nachtlicht eine Brustkrebstherapie u. U. wirkungslos machen kann, weil das Licht die nächtliche Melatoninproduktion stört, was wiederum die Tumorzellen stärkt. Beim Nachrecherchieren führte eins zum anderen, und zack: Schon muss das Autoimmunbuch um ein Kapitel erweitert werden. Wie die sogenannte circadiane Rhythmik – das Schwingen aller möglicher Abläufe in unserem Körper mit einer Periode von etwa 24 Stunden – und der nächtliche Schlaf unser Immunsystem regeln, ist nämlich hochspannend und auch für Autoimmunerkrankungen relevant.
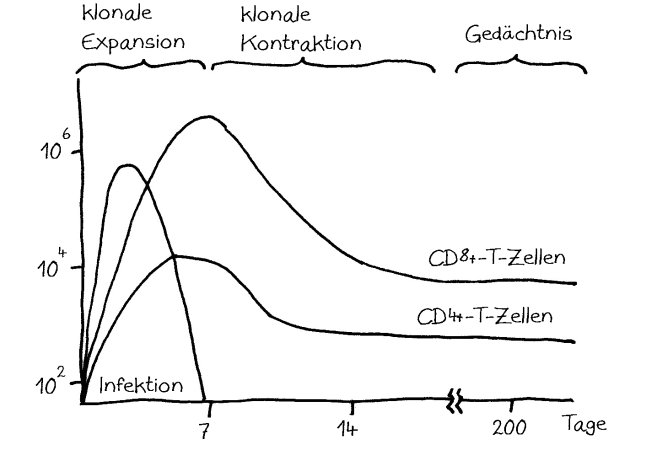
Von dem Dutzend Arbeiten, die ich zum Thema gelesen habe, empfehle ich vor allem die Übersicht „T Cell and Antigen Presenting Cell Activity During Sleep“ von Tanja Lange und Jan Born (2011), auf der die meisten der folgenden Abbildungen basieren.
Wie stellt das Immunsystem sicher, dass sich entzündungsfördernde und entzündungshemmende Signale, die angeborene und die erworbene Abwehr sowie der Th1- und der Th2-Arm der erworbenen Abwehr nicht ins Gehege kommen? Durch räumliche und zeitliche Trennung: Der Tag gehört den entzündungshemmenden Signalen, der angeborenen Abwehr und denjenigen Zellen der erworbenen Abwehr, die Pathogene unmittelbar bekämpfen: den zytotoxischen T-Zellen. Und in der Nacht – vor allem, wenn man schläft und nicht durchwacht – dominieren Entzündungsreaktionen, die uns tags bei lebensnotwendigen Aktivitäten stören würden. Außerdem wird nachts durch die Kontakte zwischen antigenpräsentierenden Zellen und T-Helferzellen das immunologische Gedächtnis angelegt.
Hormone aus der Zirbeldrüse und der Hypophyse im Gehirn sowie aus der Nebennierenrinde, deren Ausschüttung von der zentralen inneren Uhr im Hypothalamus gesteuert wird, sorgen dafür, dass die richtigen Zellpopulationen zu jeder Zeit am richtigen Ort sind – also im Blut, im Lymphsystem, im peripheren Gewebe oder im Knochenmark. Die zentrale innere Uhr basiert auf einer Handvoll Gene, deren Ableseprodukte (die Proteine PER, CRY, REV-ERB, ROR, CLOCK und BMAL) wechselseitig ihre eigene Ablesung ein- und ausschalten. Ohne äußere Impulse oszilliert diese Rückkopplung mit einer Periode von etwas mehr als 24 Stunden. Durch Tageslichtsignale – von Nervenzellen in der Netzhaut an den Hypothalamus übermittelt – wird sie auf genau 24 Stunden eingestellt.
Die zentrale Uhrzeit wird vor allem durch das Zirbeldrüsen-Hormon Melatonin an die Zellen im gesamten Körper übermittelt. Die Melatoninkonzentration ist mitten in der Nacht am höchsten, fällt noch in der Nacht steil ab und bleibt tags sehr niedrig, bis sie abends wieder anzusteigen beginnt:
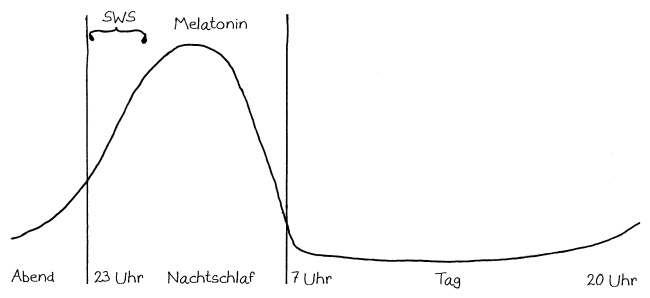 In dieser und den folgenden Abbildungen ist die Konzentration im Blut während etwas mehr als 24 Stunden dargestellt, beginnend mit dem Abend eines Tages bis zum Abend des nächsten Tages. Die beiden senkrechten Linien markieren die Nacht, in der man idealerweise zwischen 23 und 7 Uhr schläft. In der ersten Nachthälfte gerät man in den Tiefschlaf, hier wegen der englischen Bezeichnung slow-wave sleep als SWS bezeichnet. Diese Schlafphase ist für die Regelung des Immunsystems entscheidend.
In dieser und den folgenden Abbildungen ist die Konzentration im Blut während etwas mehr als 24 Stunden dargestellt, beginnend mit dem Abend eines Tages bis zum Abend des nächsten Tages. Die beiden senkrechten Linien markieren die Nacht, in der man idealerweise zwischen 23 und 7 Uhr schläft. In der ersten Nachthälfte gerät man in den Tiefschlaf, hier wegen der englischen Bezeichnung slow-wave sleep als SWS bezeichnet. Diese Schlafphase ist für die Regelung des Immunsystems entscheidend.
Bildergalerie
Da ich im Moment nicht zum ausführlichen Bloggen komme, stelle ich hier einfach die neuesten Abbildungen fürs Buch vor: unkommentiert – und damit wohl auch unverständlich. Aber das eine oder andere Element spricht vielleicht doch für sich selbst:
Und jetzt weiter im Text – oder vielmehr im Bild: Die nächste Zeichnung dreht sich um die circadiane Rhythmik des Immunsystems, also die Schwankungen von Zell- und Stoffkonzentrationen sowie -funktionen im Tagesverlauf.
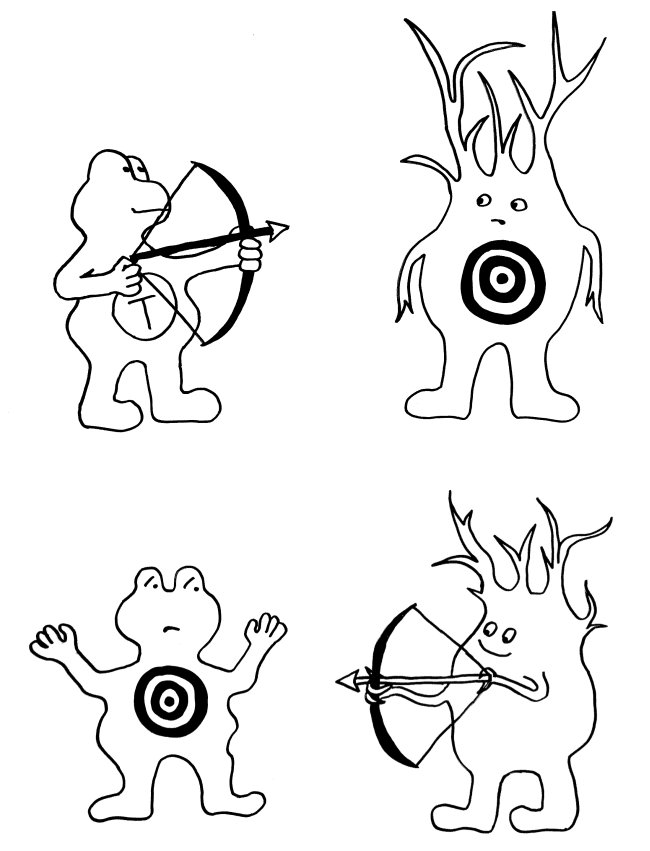
Fas/FasL: Wer zieht schneller?
Fas ist ein Rezeptor in der Membran etlicher Zelltypen im menschlichen Körper. FasL ist sein Ligand; auch er ist in der Zellmembran angesiedelt. Bindet FasL (hier: Pfeil und Bogen) an Fas (hier: Zielscheibe), so löst Fas in seiner Zelle eine Apoptose aus, einen kontrollierten Zelltod. Dieser Regulierungsmechanismus kommt in unserem Körper in mehreren Situationen zum Einsatz:
Oben: Zytotoxische T-Zellen (links) bringen so infizierte oder beschädigte Körperzellen (hier eine Nervenzelle, rechts) zum Absterben.
Mitte: In den sogenannten immunologisch privilegierten Orten, beispielsweise im Gehirn, läuft es umgekehrt: Die Zellen dort exprimieren selbst so viel FasL, dass eindringende T-Zellen (deren Membranen sowohl Fas als auch FasL enthalten) sterben, bevor sie eine Abwehrmaßnahme durchführen können.
Unten: Gegen Ende einer Immunreaktion muss die Zahl der Immunzellen im Körper stark reduziert werden (sog. Kontraktion des Immunsystems). Dazu begehen die Immunzellen Brudermord: Da sie sowohl Fas als auch FasL exprimieren, können sie sich gegenseitig ausschalten.
Versagt dieser Kontrollmechanismus, kann es zu Autoimmunerkrankungen kommen.
Blätter
 Irgendwo in Teil 3 von geplanten 5 Teilen meines Buchs habe ich (mal wieder) die Übersicht verloren: Habe ich Thema X bereits behandelt, und wenn ja: wo? Sollte ich Thema Y vielleicht besser hierhin verschieben – aber wo steckt es? Habe ich Abbildung Z eigentlich schon verwurstet, und wo finde ich die jetzt?
Irgendwo in Teil 3 von geplanten 5 Teilen meines Buchs habe ich (mal wieder) die Übersicht verloren: Habe ich Thema X bereits behandelt, und wenn ja: wo? Sollte ich Thema Y vielleicht besser hierhin verschieben – aber wo steckt es? Habe ich Abbildung Z eigentlich schon verwurstet, und wo finde ich die jetzt?
Bei aller Liebe zu Scrivener: Jetzt hilft nur noch ein Komplett-Ausdruck aller bereits verfassten Kapitel und aller bereits ausgeführten Zeichnungen. Ich muss blättern und kritzeln, um mich in meinem eigenen Buchkosmos wieder zurechtzufinden.
Im Augenblick sind es 377 Seiten und über 200 Zeichnungen, von denen gut 140 zu den bereits geschriebenen Kapiteln gehören.
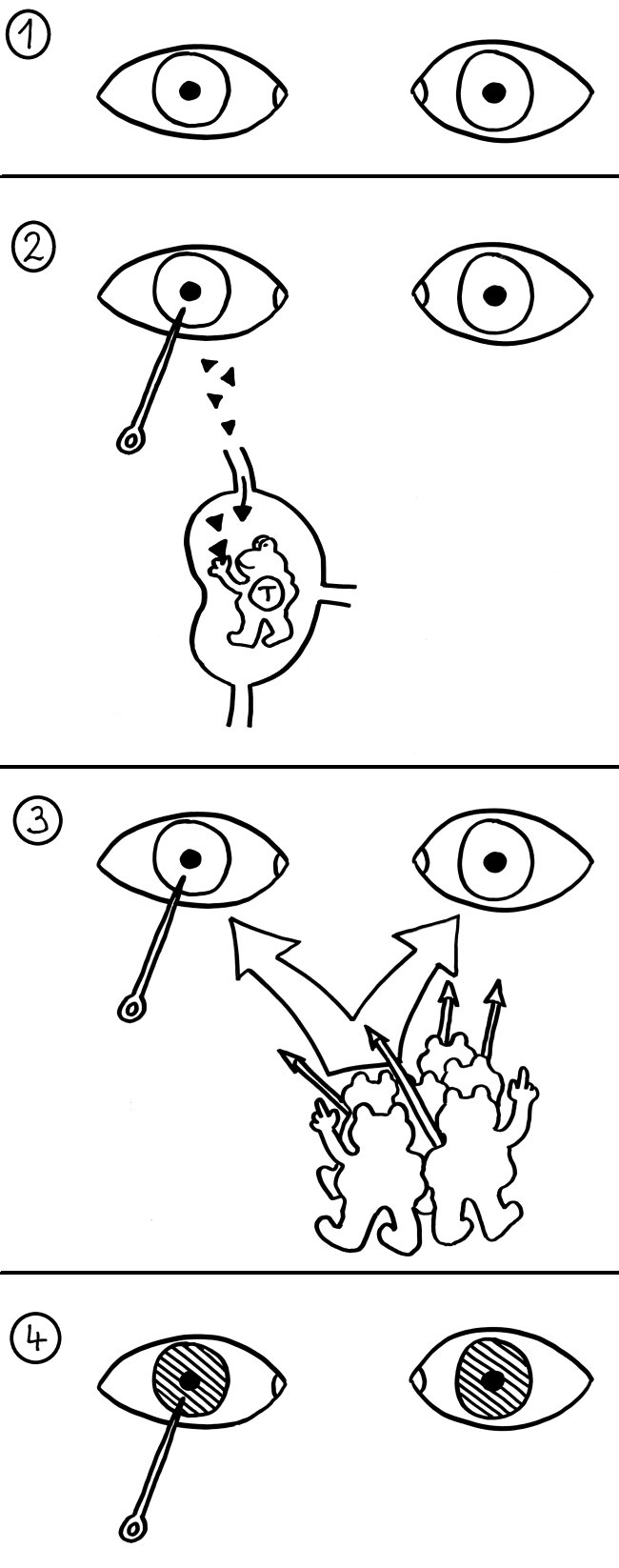
Unsympathische sympathische Ophthalmie
Die erste neue Buchskizze seit einer halben Ewigkeit: Ich schreibe gerade das Kapitel über die immunologisch privilegierten Orte. Das sind Organe und Gewebe in unserem Körper, die teilweise vom Immunsystem isoliert sind, sodass zum Beispiel Implantate in ihnen nicht abgestoßen werden. Solche Immunprivilegien dienen wohl dazu, Organe funktionsfähig zu halten, in denen eine Abwehrreaktion größeren Schaden anrichten würde als ihr Auslöser.
Die vordere Augenkammer (zwischen Hornhaut und Iris gelegen) würde sich zum Beispiel bei einer Entzündung eintrüben. Daher ist die Aktivierungsschwelle für Immunreaktionen in ihr besonders hoch. Im Normalfall gelangen Antigene aus der vorderen Augenkammer – auch Autoantigene – nicht ins Lymphsystem, sodass sie keine zu ihnen passenden T-Zellen aktivieren. Daher suchen T-Zellen diesen Ort auch nicht gezielt auf. Wie gesagt: im Normalfall. Dieses „Privileg“ ist allerdings teuer erkauft: Wenn durch eine Verletzung doch einmal Augen-Antigene in den Körper gelangen, kann das zur vollständigen Erblindung führen – durch eine Autoimmunerkrankung mit dem Namen sympathische Ophthalmie. („Sympathisch“ heißt nämlich ursprünglich „gleichzeitig betroffen“.)
1. Im Normalfall sind unsere vorderen Augenkammern vom Rest des Körpers isoliert: Die Hornhaut enthält keine Blutgefäße, die umliegenden Blutgefäße sind durch tight junctions gründlich abgedichtet und es gibt keine Lymphgefäße in unmittelbarer Nähe.
2. Wird ein Auge verletzt, können aber doch Autoantigene aus dem Inneren ins Lymphsystem und dann in den nächstgelegenen Lymphknoten gelangen. Dort treffen sie u. U. auf T-Zellen, deren Rezeptoren genau diese Antigene erkennen – und die im Rahmen der zentralen oder peripheren Toleranz-Induzierung nicht ausgeschaltet wurden, da sie „ihren“ Antigenen ja normalerweise nie begegnen. Diese T-Zellen werden nun aktiviert und vermehren sich.
3. Die aktivierten T-Zellen folgen chemischen Signalen, um zu ihrem Einsatzort zu finden – also dem Ort, an dem die Antigene vorkommen, die sie bekämpfen wollen. Sie können ja nicht wissen, dass es sich nicht um Fremdstoffe handelt, sondern um normale Inhaltsstoffe des Auges. Und sie unterscheiden auch nicht zwischen den Augen, die für sie beide nach „Ziel“ riechen.
4. Die T-Zellen dringen in beide vordere Augenkammern ein und lösen eine heftige Abwehrreaktion gegen die dortigen Autoantigene aus. Dabei trüben sich die Augen so sehr ein, dass der Betroffene einige Wochen oder Monate nach der Verletzung beidseitig erblinden kann. Heilung ist – wie bei fast allen Autoimmunerkrankungen – nicht möglich. Wenn man die Gefahr rechtzeitig erkennt, kann man aber durch Entfernen des verletzten Auges wenigstens das andere Auge retten.